
【题目】某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

请回答下列问题:
(1)装置F中发生反应的离子方程式为_________________________.(提示,高锰酸钾的还原产物为Mn2+)
(2)盛放浓盐酸的装置的名称是___________;A装置中的固体可能是____________.
(3)通入C装置的两根导管左边较长、右边较短,目的是________________________.
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:__________________________________.
【答案】2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O 分液漏斗 碱石灰或生石灰等 使密度大的氯气与密度小的氨气较快地均匀混合 3Cl2+8NH3═N2+6NH4Cl
【解析】
(1)F中发生高锰酸钾与浓盐酸的氧化还原反应,生成氯化钾、氯化锰、氯气、水;
(2)利用碱石灰与浓氨水可制取氨气;
(3)左边进入的为氨气,右边进入的为氯气,密度不同;
(4)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,以此来解答;
(1)F中发生高锰酸钾与浓盐酸的氧化还原反应,生成氯化钾、氯化锰、氯气、水,离子反应为2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O,因此,本题正确答案是:2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O;
(2)盛放浓盐酸的装置的名称是分液漏斗;碱石灰或生石灰等与浓氨水混合可制取氨气,因此,本题答案为:分液漏斗;碱石灰或生石灰等;
(3)左边进入的为氨气,右边进入的为氯气,密度不同,则导管左边较长、右边较短使密度大的氯气与密度小的氨气较快地均匀混合,因此,本题答案为:使密度大的氯气与密度小的氨气较快地均匀混合;
(4)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,该反应为3Cl2+8NH3═N2+6NH4Cl,因此,本题正确答案是:3Cl2+8NH3═N2+6NH4Cl;


科目:高中化学 来源: 题型:
【题目】一定条件下,容积为1L的密闭容器中发生反应: ![]() H=+148.9kJ·mol-1,下列各项中不能说明该反应已达化学平衡状态的是
H=+148.9kJ·mol-1,下列各项中不能说明该反应已达化学平衡状态的是
A. v(SiF4)消耗=4v(HF)生成 B. HF的体积分数不再变化
C. 容器内气体压强不再变化 D. 容器内气体的总质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是常见的焙烤食品添加剂;NH4HSO4在医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+) ________(填“等于”“大于”或“小于”) 0.1mol/L NH4HSO4中c(NH4+)。
0.1mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线如图甲所示:

(2)图甲中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填字母)。
(3)向100mL 0.1mol/L NH4Al(SO4)2溶液中滴入90ml 0.5mol/L NaOH溶液,产生白色沉淀__________克。
(4)写出NH4HSO4溶液中滴加足量NaOH溶液的化学方程式______________________________;
25℃时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图乙所示。

(5)试分析图乙中a、b、c、d四个点,水的电离程度最大的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应: ![]() H=-213.5kJ/mol,达到平衡时的数据如下:
H=-213.5kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是
A. 上述信息可推知:T12
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写下列化学用语:
(1)氯碱工业中电解饱和食盐水总反应的离子方程式________。
(2)泡沫灭火器所用的原料为硫酸铝和碳酸氢钠,用离子方程式表示泡沫灭火器的灭火原理________。
(3)向含有Mg(OH)2固体的浊液中加入浓NH4Cl溶液,Mg(OH)2固体溶解,用化学方程式解释原因________。
(4)以甲烷、空气为燃料,以KOH为电解质溶液的燃料电池,负极反应式________,正极反应式________。
(5)用惰性电极电解溶融Al2O3可以获得活泼金属Al,写出阳极的电极反应式________,总反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述中正确的是
A. 标准状况下,22.4 L水中含有的水分子数为NA
B. 1 mol Fe与足量的盐酸反应电子转移总数为3NA
C. 常温常压下,22 g CO2中含有的氧原子数为NA
D. 500 mL 1 mol·L-1MgCl2溶液中含有Cl﹣数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
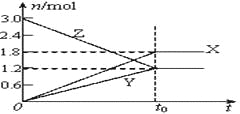
A. 该反应的化学方程式为:3X+2Y![]() 2Z
2Z
B. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
C. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com