
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为________。
(2)Na的原子结构示意图为________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为__________________________;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为________________(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg 3He,同时可得6000 kg H2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产碳酸氢铵________kg。
[答案] (1)1 (2)

(3)①高 ②SiO2+2OH-===SiO +H2O 原子晶体 ③NaCl,NaClO,Na2CO3
+H2O 原子晶体 ③NaCl,NaClO,Na2CO3
(4)3950
[解析] (3)①离子晶体的熔点与晶格能有关系,形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,晶格能越大,熔点越高;镁离子的半径小于钡离子,故氧化镁的晶格能大于氧化钡的晶格能,则氧化镁的熔点高;②氧化镁是碱性氧化物,二氧化硅是酸性氧化物,可用强碱溶液除去二氧化硅;二氧化硅是由硅原子和氧原子通过共价键形成的空间网状结构的晶体,是原子晶体;③氧化镁、炭粉和氯气制备氯化镁,另一生成物可被氢氧化钠完全吸收,则生成气体是二氧化碳,它与足量氢氧化钠反应生成碳酸钠,过量的氯气与氢氧化钠反应生成氯化钠和次氯酸钠。(4)根据化学方程式3H2+N2 2NH3,结合已知可知N2不足,则最多生成的NH3的物质的量为
2NH3,结合已知可知N2不足,则最多生成的NH3的物质的量为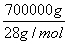 ×2,根据氮原子守恒可知最终生成碳酸氢铵的质量为
×2,根据氮原子守恒可知最终生成碳酸氢铵的质量为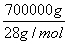 ×2×79 g·mol-1=3 950 000 g=3950 kg。
×2×79 g·mol-1=3 950 000 g=3950 kg。


科目:高中化学 来源: 题型:
下列关于原电池的叙述中,正确的是( )
A.原电池能将化学能转变为电能
B.原电池负极发生的电极反应是还原反应
C.原电池在工作时其正极不断产生电子并经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A.NH4Cl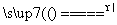 NH3↑+HCl↑
NH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2NaOH+Cl2===NaCl+NaClO+H2O
D.2Na2O2+2CO2===2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D. 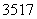 Cl与
Cl与 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液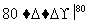 NaClO3溶液
NaClO3溶液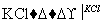 KClO3晶体①完成Ⅰ中反应的总化学方程式:
KClO3晶体①完成Ⅰ中反应的总化学方程式:
 NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是________________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是____________________________________。
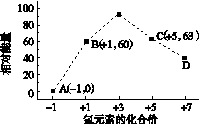
(4)一定条件下,在水溶液中1 mol Cl-、ClO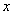 (x=1,2,3,4)的能量(kJ)相对大小如右图所示。
(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
①D是________(填离子符号)。
②B→A+C反应的热化学方程式为________________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A. W2-、X+ B. X+、 Y3+
C. Y3+、 Z2- D. X+、 Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
要设计一套实验室利用液体和液体加热反应制备气体的装置,现设计了五步操作,正确的程序是( )
①将蒸馏烧瓶固定在铁架台上
②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网
③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集器中
④检查装置的气密性(利用对固定装置微热的方法检查气密性)
⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管
A.②①⑤④③ B.④①②⑤③
C.①②⑤④③ D.①⑤④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下表给出几种氯化物的熔点和沸点:
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化铝晶体是典型的离子晶体。其中与表中数据一致的是
A.①② B.②③
C.①②④ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com