
【题目】如下表是元素周期表的短周期,请根据表中的位置,按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用元素符号填空:在这十种元素中,化学性质最稳定的是_____,通常情况下化合价只有负价而无正价的是______,原子半径最小的是_______,原子半径最大的主族元素是_________。
(2)用化学式填空:在这十种元素中,最高价氧化物的水化物碱性最强的是______,酸性最强是________,呈两性的是_________。
(3)①和②形成的最简单的化合物的结构式是_____________。
(4)元素③的气态氢化物的电子式是________________。
(5)③可以形成多种氧化物,其中一种是红棕色气体,试用化学方程式说明该气体不宜采用排水法收集的原因__________________________。
【答案】Ar F H Na NaOH HClO4 Al(OH)3 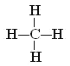
![]() 3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
【解析】
根据元素在周期表中的位置知,①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩分别是H、C、N、F、Na、Al、P、S、Cl、Ar元素,以此分析解答。
(1)稀有气体元素化学性质最不活泼,所以化学性质最不活泼的是Ar;F元素没有正化合价,所以通常情况下化合价只有负价而无正价的是F元素;原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以这几种元素中原子半径最小的是H,原子半径最大的主族元素是Na,
因此,本题正确答案是:Ar ;F ;H ;Na;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强,所以碱性最强的是NaOH,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以酸性最强的是HClO4,Al(OH)3呈两性,
因此,本题正确答案是:NaOH ;HClO4 ;Al(OH)3;
(3) ①和②形成的最简单有机化合物为甲烷,甲烷为正四面体结构,甲烷的结构式为: ,
,
因此,本题正确答案是:  ;
;
(4) 元素③的气态氢化物为NH3,其电子式为:![]() ,
,
因此,本题正确答案是: ![]() ;
;
(5)③可以形成多种氧化物,其中一种红棕色气体为NO2,二氧化氮和水反应生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO,
因此,本题正确答案是:3NO2+H2O=2HNO3+NO。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】化学是一把双刃剑,利用得好会给人类带来福祉,利用不好会给人类带来毁灭性的灾难。
(1)二战期间日本在战场上大量使用毒气弹里的毒气是芥子气,芥子气的结构简式为: ClCH2CH2-S-CH2CH2Cl。
①芥子气中四个碳原子是否在一条直线上________(填“是” 或“否”)。
②芥子气的核磁共振氢谱图上有________个吸收峰,其峰面积之比为________。
(2)苏合香醇可以用作食用香精,其结构简式如图所示:
![]()
①苏合香醇的分子式为________。
②下列物质不能与苏合香醇发生反应的是________ (选填序号)。
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
③苏合香醇在铜作催化剂时发生氧化反应的化学方程式为________。
④苏合香醇发生消去反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是

A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图装置(启普发生器)制取氢气,欲使得到氢气的速率加快,下列措施可行的是
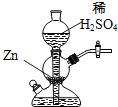
A. 将稀硫酸改为浓硫酸
B. 向稀硫酸中加入少量![]() 固体
固体
C. 向稀硫酸中加入![]() 溶液
溶液
D. 给装置中发生反应的部分加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z均为短周期主族元素,已知它们的原子序数的关系为X+Z=2Y,且Z的最高价氧化物对应的水化物是强酸。则下列有关说法正确的是
A. 若X是Na,则Z的最高价一定为偶数
B. 若X是O,则YX一定是离子化合物
C. 若Y是O,则非金属性Z>Y>X
D. 若Y是Na,则X、Z不可能是同一主族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
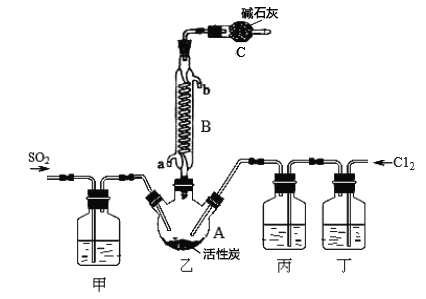
(1)写出浓盐酸和氯酸钾反应制取Cl2的离子方程式_________________。
(2)丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是一种重要的有机化工原料。实验室合成环己酮的反应如下:
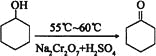
环己醇和环己酮的部分物理性质见下表:
物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm—3、20 ℃) | 溶解性 |
环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是 。
(2)b中水层用乙醚萃取的目的是 。
(3)以下关于萃取分液操作的叙述中,不正确的是 。
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图( )用力振荡
)用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是 。蒸馏除乙醚的操作中,采用的加热方式为 。
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 。
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如图:
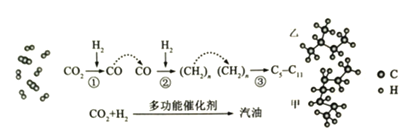
回答下列问题:
(1)二氧化碳分子中的化学键是______,物质乙的结构简式是______。
(2)写出反应![]() 的化学方程式______。
的化学方程式______。
(3)实验室常用纯净碳酸钙与稀盐酸反应制取二氧化碳气体,反应过程中产生二氧化碳的体积V(CO2)与时间关系如图:
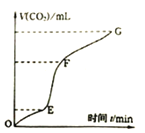
①由图象分析,化学反应速率最快一段是______。
②为了增大上述化学反应的反应速率,欲向溶液中加入下列物质或采取如下操作,你认为可行的是______![]() 填写序号
填写序号![]() 。
。
A.蒸馏水 B.氯化钠溶液 C.浓盐酸 D.加热
(4)二氧化碳能与氢氧化钠溶液反应,当二氧化碳与氢氧化钠反应的物质的量之比为2∶3时,溶液中的溶质是________。(填化学式)
(5)在一定条件下,工业上也可用CO2合成甲醇(CH3OH),其化学方程式为:CO2+3H2![]() CH3OH+H2O。将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,tmin时测得甲醇的物质的量为cmol。计算0-tmin内CO2的反应速率为______mol/(L·s)。[X的反应速率ν(X)=
CH3OH+H2O。将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,tmin时测得甲醇的物质的量为cmol。计算0-tmin内CO2的反应速率为______mol/(L·s)。[X的反应速率ν(X)=![]() ]
]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com