
ЁОЬтФПЁПЪЏгЭЪЧЙЄвЕЕФбЊвКЃЌЭЈЙ§ЫќПЩвдЕУЕНКмЖрживЊЕФЛЏЙЄВњЦЗЁЃ

вбжЊЃК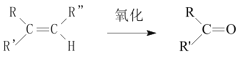 +
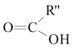
+
ЃЈ1ЃЉBКЭAЮЊЭЌЯЕЮяЃЌBЕФНсЙЙМђЪНЮЊ____ЃЌЦфКЌгаЕФЙйФмЭХУћГЦЮЊ____ЁЃ
ЃЈ2ЃЉЗДгІЂйЕФЛЏбЇЗНГЬЪНЮЊ___ЃЌЦфЗДгІРраЭЮЊ____ЁЃ
ЃЈ3ЃЉаДГіМьбщC3H5ClжаКЌгаЕФClдзгЕФЗНЗЈ____ЁЃ
ЃЈ4ЃЉCЕФНсЙЙМђЪНЮЊ___ЁЃ
ЃЈ5ЃЉЗДгІЂмЕФЛЏбЇЗНГЬЪНЮЊ_____ЁЃ
ЃЈ6ЃЉЩшМЦвЛЬѕгЩввЯЉЮЊдСЯжЦБИDЕФКЯГЩТЗЯпЃЈЦфЫћЮоЛњдСЯШЮбЁЃЉЁЃ___
КЯГЩТЗЯпСїГЬЭМЪОР§ШчЯТЃКCH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrH2C-CH2BrЁЃ
BrH2C-CH2BrЁЃ
ЁОД№АИЁПCH2=CHCH3 ЬМЬМЫЋМќ CH2=CH2+H2O![]() CH3CH2OH МгГЩЗДгІ ШЁбљЃЌЯШМгШыNaOHШмвКМгШШЃЌРфШДКѓМгШыЯЁЯѕЫсЫсЛЏЃЌдйМгШыAgNO3ШмвКЃЌгаАзЩЋГСЕэЩњГЩдђКЌгаClдзгЃЌЗёдђВЛКЌ HCOO-COOH CH2=CHCH2Cl+NaOH
CH3CH2OH МгГЩЗДгІ ШЁбљЃЌЯШМгШыNaOHШмвКМгШШЃЌРфШДКѓМгШыЯЁЯѕЫсЫсЛЏЃЌдйМгШыAgNO3ШмвКЃЌгаАзЩЋГСЕэЩњГЩдђКЌгаClдзгЃЌЗёдђВЛКЌ HCOO-COOH CH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl CH2=CH2
CH2=CHCH2OH+NaCl CH2=CH2![]() CH3CH2OH
CH3CH2OH
CH2=CH2![]() BrCH2-CH2Br
BrCH2-CH2Br![]() HOCH2-CH2OH
HOCH2-CH2OH![]()
![]()
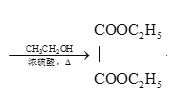
ЁОНтЮіЁП
гЩСїГЬЭМПЩжЊAЮЊввЯЉЃЌгыЫЎМгГЩЕУввДМЃЌгыCЗДгІЩњГЩDЃЌCЮЊ HCOO-COOHЃЛ
BЮЊCH2=CHCH3ЃЌгыТШЦјЗЂЩњШЁДњЗДгІЕУCH2=CHCH2ClЃЌдйЗЂЩњCH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaClЃЌЕУCH2=CHCH2OHЃЌИљОнаХЯЂбѕЛЏЩњГЩCЁЃ
CH2=CHCH2OH+NaClЃЌЕУCH2=CHCH2OHЃЌИљОнаХЯЂбѕЛЏЩњГЩCЁЃ
ЃЈ1ЃЉAЮЊввЯЉЃЌBКЭAЮЊЭЌЯЕЮяЃЌга3ИіЬМЃЌЫљвдBЕФНсЙЙМђЪНЮЊCH2=CHCH3ЃЌЦфКЌгаЕФЙйФмЭХУћГЦЮЊЬМЬМЫЋМќЁЃ
ЃЈ2ЃЉCH2=CH2КЭH2OЗЂЩњМгГЩЗДгІЃЌЗДгІЂйЕФЛЏбЇЗНГЬЪНЮЊ CH2=CH2+H2O![]() CH3CH2OHЃЌЦфЗДгІРраЭЮЊМгГЩЗДгІЁЃ
CH3CH2OHЃЌЦфЗДгІРраЭЮЊМгГЩЗДгІЁЃ
ЃЈ3ЃЉC3H5ClЪЧЙВМлЛЏКЯЮяЃЌдкЫЎжаФбЕчРыЃЌвЊЯШЫЎНтВњЩњТШРызгЃЌМьбщC3H5ClжаКЌгаЕФClдзгЕФЗНЗЈЃКШЁбљЃЌЯШМгШыNaOHШмвКМгШШЃЌРфШДКѓМгШыЯЁЯѕЫсЫсЛЏЃЌдйМгШыAgNO3ШмвКЃЌгаАзЩЋГСЕэЩњГЩдђКЌгаClдзгЃЌЗёдђВЛКЌЁЃ
ЃЈ4ЃЉAЮЊввЯЉЃЌгыЫЎМгГЩЕУввДМЃЌгыCЗДгІЩњГЩDЃЌCЮЊ HCOO-COOHЁЃ
ЃЈ5ЃЉТБДњЬўдкМюадЬѕМўЯТЗЂЩњЫЎНтЗДгІЃЌЂмЕФЛЏбЇЗНГЬЪНЮЊCH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl ЁЃ
CH2=CHCH2OH+NaCl ЁЃ
ЃЈ6ЃЉввЯЉгыфхМгГЩЃЌЕУBrCH2-CH2BrЃЌдкМюадЬѕМўЯТЫЎНтГЩHOCH2-CH2OHЃЌдйбѕЛЏЕУввЖўЫсЃЌзюКѓОѕЅЛЏЗДгІЕУDЃЌгЩввЯЉЮЊдСЯжЦБИDЕФКЯГЩТЗЯп
CH2=CH2![]() CH3CH2OH
CH3CH2OH
CH2=CH2![]() BrCH2-CH2Br
BrCH2-CH2Br![]() HOCH2-CH2OH
HOCH2-CH2OH![]()
![]()
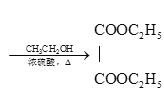 ЁЃ
ЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЪЧВПЗжЖЬжмЦкдЊЫидзгАыОЖгыдзгађЪ§ЕФЙиЯЕЭМЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
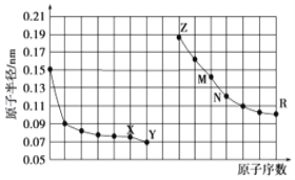
A.MЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяФмЗжБ№гыZЁЂRЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЗДгІ
B.ПЩгУЛЙдМСЛЙдRЕФМђЕЅРызгжЦБИRЕЅжЪ
C.XЁЂNСНжждЊЫизщГЩЕФЛЏКЯЮяШлЕуКмЕЭ
D.МђЕЅРызгЕФАыОЖЃКZЃМXЃМY
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌгУЛЏбЇгУгяЛиД№ЯТСаЮЪЬтЃК
ЂёA | ЂђA | ЂѓA | ЂєA | ЂѕA | ЂіA | ЂїA | |
Жў | Ђй | Ђк | Ђл | ||||
Ш§ | Ђм | Ђн | Ђо | Ђп | Ђр |
ЃЈ1ЃЉЂлЕФдЊЫиЗћКХЮЊ___ЃЌдЊЫиЂмгыЂпаЮГЩЛЏКЯЮяЕФЕчзгЪНЮЊ___ЁЃ
ЃЈ2ЃЉБШНЯдЊЫиЂйКЭЂоЕФдзгАыОЖДѓаЁЃКЂй___ЃЈЬюЁА>ЁБЛђЁА<ЁБЃЉЂо
ЃЈ3ЃЉдЊЫиЂоЕФРызгНсЙЙЪОвтЭМЮЊ___ЁЃ
ЃЈ4ЃЉдЊЫиЂйКЭЂраЮГЩЕФЛЏКЯЮяжаКЌгаЕФЛЏбЇМќЮЊ___ЁЃ
ЃЈ5ЃЉдЊЫиЂкЁЂЂнЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяжЎМфЗДгІЕФРызгЗНГЬЪНЮЊ___ЁЃ
ЃЈ6ЃЉЙЄвЕЩЯвБСЖдЊЫиЂоЕФЕЅжЪЕФЛЏбЇЗНГЬЪНЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЬѕМўЯТЃЌЯђ1 LУмБеШнЦїжаГфШы3 mol X ЦјЬхКЭ1 mol YЦјЬхЃЌЗЂЩњЗДгІ2X(g)ЃЋ2Y(g)![]() 3Z(g)ЃЋ2W(g)ЃЌДяЕНЛЏбЇЦНКтЪБЃЌВтГіЕФЯТСаИїЩњГЩЮяХЈЖШЕФЪ§ОнжаПЯЖЈДэЮѓЕФЪЧ(ЁЁЁЁ)
3Z(g)ЃЋ2W(g)ЃЌДяЕНЛЏбЇЦНКтЪБЃЌВтГіЕФЯТСаИїЩњГЩЮяХЈЖШЕФЪ§ОнжаПЯЖЈДэЮѓЕФЪЧ(ЁЁЁЁ)
A.c(Z)ЃН0.75 mol/LB.c(Z)ЃН1.2 mol/L
C.c(W)ЃН0.8 mol/LD.c(W)ЃН1 mol/L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвьЮьЖўЯЉЪЧживЊЕФгаЛњЛЏЙЄдСЯЃЌЦфНсЙЙМђЪНЮЊЃК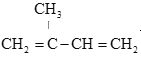 вьЮьЖўЯЉЕФвЛжжжЦБИЗНЗЈШчЭМЫљЪОЃК
вьЮьЖўЯЉЕФвЛжжжЦБИЗНЗЈШчЭМЫљЪОЃК
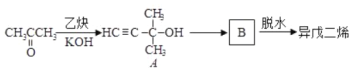
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉAжаКЌбѕЙйФмЭХЗЂЩњЕФЗДгІга____ЁЃЃЈЬюЗДгІРраЭЃЉ
ЃЈ2ЃЉBЕФНсЙЙМђЪНЮЊ___ЁЃBЕФЭЌЗжвьЙЙЬхYФмЗЂЩњвјОЕЗДгІЃЌдђYПЩФмЕФНсЙЙга____жжЁЃ
ЃЈ3ЃЉЩшМЦгЩвьЮьЖўЯЉжЦЕУ![]() ЕФТЗЯпЁЃ____ЁЃ
ЕФТЗЯпЁЃ____ЁЃ
КЯГЩТЗЯпГЃгУЕФБэЪОЗНЪНЮЊЃКA![]() BЁЁ
BЁЁ![]() ФПБъВњЮя
ФПБъВњЮя
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋ 1molCOКЭ 2molH2ГфШывЛШнЛ§ЮЊ 1LЕФУмБеШнЦїжаЃЌЗжБ№дк250ЁуCЁЂTЁуCЯТЗЂЩњЗДгІЃКCO(g)+2H2(g) ![]() CH3OH(g)ЁЃИљОнЭМЃЌЯТСаЗжЮіжае§ШЗЕФЪЧЃЈ ЃЉ
CH3OH(g)ЁЃИљОнЭМЃЌЯТСаЗжЮіжае§ШЗЕФЪЧЃЈ ЃЉ
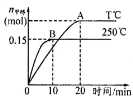
A. 250ЁуCЪБЃЌЗДгІдкЧА10sЕФЦНОљЫйТЪІд(H2)=0.015mol/(LЁЄmin)
B. ЦНКтЪБCOЕФзЊЛЏТЪЃК250ЁуCЃОTЁуC
C. ЗДгІДяЦНКтКѓЃЌЦфЫћЬѕМўВЛБфЃЌШєМѕаЁШнЛ§ЬхЛ§ЃЌCO ЬхЛ§ЗжЪ§діДѓ
D. ИУЗДгІЕФе§ЗДгІЪЧЗХШШЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІЕФРызгЗНГЬЪНЪщаДе§ШЗЕФЪЧ( )
A.![]() гыЫЎЗДгІЃК
гыЫЎЗДгІЃК![]() +
+![]() =
=![]()
B.ЬњгыЯЁСђЫсЗДгІЃК2Fe+6![]() =2
=2![]() +3
+3![]() Ёќ
Ёќ
C.![]() ШмвККЭ
ШмвККЭ![]() ШмвКЗДгІЃК
ШмвКЗДгІЃК![]() Ё§
Ё§
D.CaCO3КЭЯЁЯѕЫсЗДгІЃКCaCO3+![]() =Ca2++
=Ca2++![]() Ёќ+
Ёќ+![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЙЬЬхЗлФЉгЩNa2OгыNa2O2зщГЩЃЌНЋЦфЗжГЩЕШСПЕФЖўЗнЃЌвЛЗнгызуСПЕФCO2ЦјЬхзїгУЃЌЗЂЯжИУЙЬЬхжЪСПдіМгСЫ10.0gЃЌЭЌЪБЩњГЩСЫаТЕФЦјЬхAЃЛСэвЛЗнШмгкЙ§СПЕФбЮЫсКѓЃЌОеєЗЂНсОЇЃЌзюКѓЕУЕНЙЬЬхЕФжЪСПЮЊ35.1gЃЌЪдМЦЫуЃК
ЃЈ1ЃЉAЦјЬхдкБъПіЯТЕФЬхЛ§ЪЧ_____________L
ЃЈ2ЃЉЙЬЬхжаNa2OгыNa2O2ЕФЮяжЪЕФСПжЎБШЪЧ___________ЃК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАТЬЫЎЧрЩНОЭЪЧН№ЩНвјЩНЁБЃЌвђДЫбаОПNOxЁЂSO2ЕШДѓЦјЮлШОЮяЕФЭзЩЦДІРэОпгаживЊвтвхЁЃ
(1)SO2ЕФХХЗХжївЊРДздгкУКЕФШМЩеЃЌЙЄвЕЩЯГЃгУАБЫЎЮќЪеЗЈДІРэЮВЦјжаЕФSO2ЁЃ
вбжЊЮќЪеЙ§ГЬжаЯрЙиЗДгІЕФШШЛЏбЇЗНГЬЪНШчЯТЃК
ЂйSO2(g)+NH3ЁЄH2O(aq)=NH4HSO3(aq) ІЄH1=a kJ/molЃЛ
ЂкNH3ЁЄH2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) ІЄH 2=b kJ/molЃЛ
Ђл2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ІЄH 3=c kJ/molЁЃ
дђЗДгІ2SO2(g)+4NH3ЁЄH2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)ЕФІЄH =______kJ/molЁЃ
(2)ШМУКЗЂЕчГЇГЃРћгУЗДгІ2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ІЄH =-681.8 kJ/molЖдУКНјааЭбСђДІРэРДМѕЩйSO2ЕФХХЗХЁЃЖдгкИУЗДгІЃЌдкЮТЖШЮЊT KЪБЃЌНшжњДЋИаЦїВтЕУЗДгІдкВЛЭЌЪБМфЕуЩЯИїЮяжЪЕФХЈЖШШчЯТЃК
2CaSO4(s)+2CO2(g) ІЄH =-681.8 kJ/molЖдУКНјааЭбСђДІРэРДМѕЩйSO2ЕФХХЗХЁЃЖдгкИУЗДгІЃЌдкЮТЖШЮЊT KЪБЃЌНшжњДЋИаЦїВтЕУЗДгІдкВЛЭЌЪБМфЕуЩЯИїЮяжЪЕФХЈЖШШчЯТЃК
ЪБМф/min ХЈЖШ/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
Ђй0~10 minФкЃЌЦНОљЗДгІЫйТЪv(SO2)=___________mol/(LЁЄmin)ЁЃ
Ђк30 minКѓЃЌжЛИФБфФГвЛЬѕМўЃЌЗДгІжиаТДяЕНЦНКтЁЃИљОнЩЯБэжаЕФЪ§ОнХаЖЯЃЌИФБфЕФЬѕМўПЩФмЪЧ___________ЃЈЬюзжФИЃЉЁЃ
AЃЎМгШывЛЖЈСПЕФЗлзДЬМЫсИЦ BЃЎЭЈШывЛЖЈСПЕФO2
CЃЎЪЪЕБЫѕаЁШнЦїЕФЬхЛ§ DЃЎМгШыКЯЪЪЕФДпЛЏМС
(3)NOxЕФХХЗХжївЊРДздгкЦћГЕЮВЦјЃЌПЩВЩгУNSR(NOxДЂДцЛЙд)НјааДІРэЃЌNOxЕФДЂДцКЭЛЙддкВЛЭЌЪБЖЮНЛЬцНјааЃЌШчЭМaЫљЪОЁЃ

ЂйЭЈЙ§BaOКЭBa(NO3)2ЕФЯрЛЅзЊЛЏЪЕЯжNOxЕФДЂДцКЭЛЙдЁЃДЂДцNOxЕФЮяжЪЪЧ_________ЁЃ
ЂкNOxДЂДцзЊЛЏЮЊBa(NO3)2Й§ГЬжаЃЌВЮМгЗДгІЕФNOКЭO2ЕФЮяжЪЕФСПжЎБШЮЊ_________ЁЃ
(4)гаШЫРћгУЗДгІC(s)+2NO(g)![]() N2(g)+CO2(g) ІЄH=34.0 kJ/molЃЌгУЛюадЬПЖдNOНјааЮќИНЁЃдкУмБеШнЦїжаМгШызуСПЕФCКЭвЛЖЈСПЕФNOЦјЬхЃЌБЃГжКубЙдкВЛЭЌЮТЖШЯТЗЂЩњИУЗДгІЃЌВЂЗжБ№дкtУыЪБВтЕУNOЕФзЊЛЏТЪЃЌШчЭМЫљЪОЃК
N2(g)+CO2(g) ІЄH=34.0 kJ/molЃЌгУЛюадЬПЖдNOНјааЮќИНЁЃдкУмБеШнЦїжаМгШызуСПЕФCКЭвЛЖЈСПЕФNOЦјЬхЃЌБЃГжКубЙдкВЛЭЌЮТЖШЯТЗЂЩњИУЗДгІЃЌВЂЗжБ№дкtУыЪБВтЕУNOЕФзЊЛЏТЪЃЌШчЭМЫљЪОЃК

ЂйгЩЭМПЩжЊЃЌ1050 KЧАЗДгІжаNOЕФзЊЛЏТЪЫцЮТЖШЩ§ИпЖјдіДѓЃЌЦфдвђЮЊ _______________ЃЛдк1100 KЪБЃЌCO2ЕФЬхЛ§ЗжЪ§ЮЊ___________ЁЃ
ЂкгУФГЮяжЪЕФЦНКтЗжбЙДњЬцЦфЮяжЪЕФСПХЈЖШвВПЩвдБэЪОЛЏбЇЦНКтГЃЪ§ЃЈМЧзїKpЃЉЃЌдк1050K1.1ЁС106 PaЪБЃЌИУЗДгІЕФЛЏбЇЦНКтГЃЪ§Kp=______________________ЁЃ
[вбжЊЃКЦјЬхЗжбЙ(PЗж)=ЦјЬхзмбЙ(P)ЁСЬхЛ§ЗжЪ§]
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com