
����Ŀ����1����һ�鴿����пƬ����װ��ϡ������ձ���ɹ۲쵽пƬ�������ݣ���ƽ�в���һ��ͭƬ(пƬ��ͭƬ���Ӵ�)���ɹ۲쵽ͭƬ��________(������������û����)���ݲ��������õ��߰�пƬ��ͭƬ��������(��ͼA)�����һ��ԭ��أ�����Ϊ________�������ĵ缫��ӦʽΪ________________________��
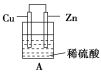 ����
����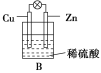
��2������ձ������װ�����2 mol/L 500 mL��ϡ������Һ������ͭпԭ���(��ͼB���������������û����ʧ)�����ڱ�״�����ռ���11.2 L������ʱ�����ʱ�ձ�����Һ����������ʵ���Ũ��Ϊ(��Һ����仯���Բ���)____________________��
��3������������ԭ���ԭ�������˸��ָ����ĵ�أ��ϵ�ر�����м��д����������ѱ��ᵽ�����ճ̣�����Ҫԭ����________________��
A���������õ����ǵĽ���
B����ֹ����й����Ӻ�Ǧ���ؽ������Ӷ�������ˮԴ����Ⱦ
C����ֹ�������©�ĵ��Һ��ʴ������Ʒ
D����������ʯī�缫
���𰸡�û�� п 2H����2e��=H2�� 1 mol/L B
��������
(1)����ͭ�������Ӧ��пƬ��ͭƬ�������γɵ�ԭ����У�����ͭΪ������пΪ������
(2)���ݵ缫��Ӧ����ʽ�����㣻
(3)�Ͼɵ�غ����ؽ������ӣ�Ӧ��ֹ�ؽ������Ӷ�������ˮԴ����Ⱦ��
(1)ϡ�����Zn�����û���Ӧ�����������ڽ������˳����У�Cu����H�ĺ��棬Cu��ϡ�����Ӧ������ͭƬ��û�����ݣ��õ��߰�пƬ��ͭƬ�������������һ��ԭ��أ�п��ʧ������������ͭ�������������������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ2H����2e��=H2����
(2)����������Ӧ��2H����2e��=H2�������ڱ�״�����ռ���11.2L����0.5mol������ʱ��ת�Ƶ�����1mol�����ĵ����������ʵ���Ϊ1mol����������0.5mol����ʣ����������ʵ���Ϊ2mol/L��0.5L0.5mol=0.5mol������ʣ��������Ũ��c=![]() =
=![]() =1mol/L��
=1mol/L��
(3)�Ͼɵ���к��й����Ӻ�Ǧ���ؽ������ӣ��������к�����������ˮԴ����Ⱦ���������ⶪ�����Ͼɵ�ؼ��д�����Ҫ������Ⱦ���⣬��ѡB��


 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ���������ȷ���ǣ�
A. HCl �ĵ���ʽ��![]() B. F���ṹʾ��ͼ��
B. F���ṹʾ��ͼ�� ![]()
C. H2 ȼ�յ��Ȼ�ѧ����ʽ�� 2H2 (g) + O2 (g) = 2H2O (g) ��H = - 571.6 kJ��mol��1D. Cl2 ��ˮ��Ӧ�����ӷ���ʽ�� Cl2 + H2O = 2H+ +Cl�� + ClO-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������У���ij��̼ԭ���������ĸ���ͬ��ԭ�ӻ�ԭ����ʱ������̼ԭ�ӳ�Ϊ������̼ԭ�ӡ������磬�����л�������д���*��̼ԭ�Ӿ�������̼ԭ�ӡ����л���ֱ������з�Ӧ�����ɵ��л���������Ժ�������̼ԭ�ӵ���

A. ��������Һ���÷���������ӦB. ������������![]() ��Ӧ
��Ӧ
C. �����ᷢ��������ӦD. ��NaOH��Һ���������·�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ϳ��������ڱ���ͬ��Ԫ�ص���������ݱ����о�Ԫ�ص�ԭ�ӽṹ�����ʡ��ش��������⣺
(1)�ִ���ѧ�У�������_____��������������Ԫ�ء�
(2)����Ԫ���У�����������Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ_____(��Ԫ�ط��Żش�)����̬SO3Ϊ������״̬������ӿռ乹��Ϊ_____����SO3��������(SO3)3�Ļ�״�ṹ��ͼ��ʾ����ýṹ��Sԭ�ӵ��ӻ��������Ϊ_____��
(3)±��Ԫ�ص��⻯���У�H��F���ļ��ܣ�H��Cl���ļ��ܣ�H��Br���ļ��ܣ�ԭ����_____��
(4)�����ܡ���ͬ����Ԫ�����ڱ���_____�壬���ǵ����������γɸ���������֪���ž�u��![]() ��nΪ����ԭ�ӻ����ӵĵ���������ʵ���������[Co(NH3)4Cl2]Cl��u��0�������������ӵĻ��ϼ�Ϊ_____����۵����Ų�ͼΪ_____��
��nΪ����ԭ�ӻ����ӵĵ���������ʵ���������[Co(NH3)4Cl2]Cl��u��0�������������ӵĻ��ϼ�Ϊ_____����۵����Ų�ͼΪ_____��
(5)��֪��ͭ����Ϊ�����������ܶѻ���ͭԭ�Ӱ뾶Ϊrpm�������ӵ�������NA��ʾ����ͭ�����ܶȵļ���ʽΪ_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����廯����CaFe(CO3)2�ڿ����м��ȷ�Ӧ����CO2��Fe2O3��CaO���ش��������⣺
(1)CO2�ĵ���ʽΪ_____��
(2)������Ӧ�����е�CaO����ȼú�У���������_____��
A����������ЧӦB������SO2���ŷ�C������⻯ѧ����D������������
(3)���ʵ��֤��������������к�����������ȡ�����������Թ��У�_____��
(4)CaFe(CO3)2�ڿ����м��ȷ�Ӧ�Ļ�ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2NO(g)��Br2(g)![]() 2NOBr(g) ��H=��a kJ��mol��1 (a>0)���䷴Ӧ��������
2NOBr(g) ��H=��a kJ��mol��1 (a>0)���䷴Ӧ��������
��NO(g)��Br2(g)![]() NOBr2(g) �� ��NO(g)��NOBr2(g)
NOBr2(g) �� ��NO(g)��NOBr2(g)![]() 2NOBr(g) ��
2NOBr(g) ��
�����йظ÷�Ӧ��˵����ȷ���ǣ� ��
A. �÷�Ӧ��������Ҫȡ���ڢٵĿ���
B. NOBr2�Ǹ÷�Ӧ�Ĵ���
C. ����Ӧ�Ļ�ܱ��淴Ӧ�Ļ��Сa kJ��mol��1
D. ����Br2(g)Ũ�����������Ӱٷ���, �ӿ췴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ����������ʯī������ʢ�б���NaCl��Һ��U���С����з�����ȷ�ģ���

A. K1�պϣ������Ϸ����ķ�ӦΪ2H����2e��=H2��
B. K1�պϣ�ʯī����Χ��Һ������ǿ
C. K2�պϣ��������ᱻ��ʴ��������������������������
D. K2�պϣ���·��ͨ��0.002NA������ʱ������������0.001mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£������pH����ͬ�������AlCl3��Һ��ˮϡ��ʱ��pH�仯������ͼ�������й�˵����ȷ����( )
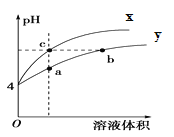
A.Al(OH)3�ĵ��뷽��ʽΪ��Al(OH)3��Al3+��3OH��
B.a����Һ���У� c(H��)��c(Al3+)��c(OH��) ��3c(Cl��)
C.����X��ʾ����ϡ���̵�pH�仯
D.b��c����Һc(OH��)��c(Cl��)�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦmA���̣�+nB������![]() pC������+qD����������Ӧ������������������ʱC�İٷֺ���C%���¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��������������ȷ����
pC������+qD����������Ӧ������������������ʱC�İٷֺ���C%���¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��������������ȷ����
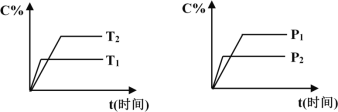
A. �ﵽƽ���ʹ�ô�����C%������
B. �ﵽƽ����������¶ȡ���ѧƽ�����淴Ӧ�����ƶ�
C. ����ʽ��n>p+q
D. �ﵽƽ�������A���������ڻ�ѧƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com