
【题目】下列化学用语表达正确的是:
A. HCl 的电子式:![]() B. F-结构示意图:
B. F-结构示意图: ![]()
C. H2 燃烧的热化学方程式: 2H2 (g) + O2 (g) = 2H2O (g) △H = - 571.6 kJ·mol-1D. Cl2 与水反应的离子方程式: Cl2 + H2O = 2H+ +Cl- + ClO-
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,反应![]() 达到反应限度的标志是:
达到反应限度的标志是:
A. 正、逆反应速率相等且都等于零
B. c(A2):c(B2):c(AB)= 1:1:2
C. A2、B2和AB的物质的量不再改变
D. 单位时间内消耗n molA2的同时生成2nmolAB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
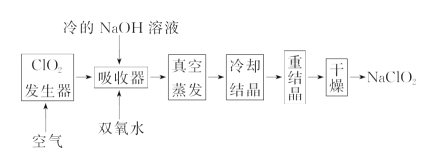
(1)ClO2气体发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为____________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为________________________________。
(4)CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为_______________。
②用CO、O2和固体电解质还可以制成如下图所示的燃料电池,则电极d的电极反应式为__________。
(5)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图所示。
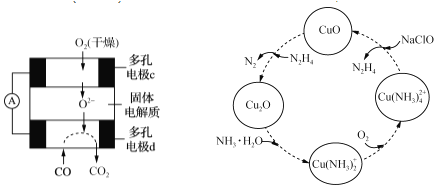
①在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
②加入NaClO时发生的反应为:
Cu(NH3)42++2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是
A.利用废弃的秸秆生产生物质燃料乙醇B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物D.利用蒸馏法从海水中分离出淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯和乙烷的说法中错误的是![]()
![]()
A. 乙烯是平面分子,乙烷分子中所有原子不可能在同一平面内
B. 溴的四氯化碳溶液和酸性![]() 溶液都可以鉴别乙烯和乙烷
溶液都可以鉴别乙烯和乙烷
C. 溴的四氯化碳溶液和酸性![]() 溶液都可以除去乙烷中混有的乙烯
溶液都可以除去乙烷中混有的乙烯
D. 乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应能实现的是( )
A. Al-Al2O3-Al(OH)3-NaAlO2 B. Si-SiO2-H2SiO3-Na2SiO3
C. Cu-CuO-Cu(OH)2-CuSO4 D. Na-Na2O2-Na2CO3-NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
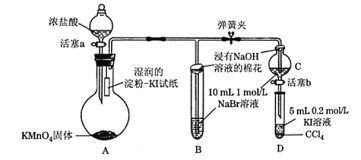
实验过程:
Ⅰ. 打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ. 当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ. 当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:
(1)A中产生黄绿色气体,其电子式是_____。实验室在加热条件下制取该气体的离子方程式为_______。
(2)验证氯气的氧化性强于碘单质的实验现象是____________。
(3)C中溶液发生反应的离子方程式是_______________。
(4)过程Ⅲ实验的目的:甲同学认为试管B的作用就是吸收尾气,防止多余Cl2污染空气,因此B中盛装的最佳试剂应该为________。
乙同学经分析认为,B中溶液由黄色变为棕红色,发生反应的化学方程式为____________,以此说明C中_________,从而得出D中氧化I-的氧化剂必为Br2,因此B装置是必不可少的。
(5)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象为___________,发生反应的离子方程式为_________。
(6)氯、溴、碘单质的氧化性逐渐减弱的本质原因:同主族元素从上到下_________,得电子能力逐渐减弱。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com