
����Ŀ�����в���Ԫ�ص�������ԭ��(�����)�ṹ���±���ʾ��
Ԫ�ر�� | Ԫ��������ԭ��(�����)�ṹ |
T | �����������Ǵ�����������3�� |
X | �������������۵Ĵ�����Ϊ2�������µ���Ϊ���� |
Y | M���K����1������ |
Z | ��������Ԫ�صĽ��������а뾶��С |
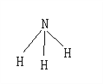
��1������Ԫ��T��ԭ�ӽṹʾ��ͼ��_________________��
��2��Ԫ��Y��Z��Ƚ����Խ�ǿ����Y�����в���֤����һ��ʵ����____(����ĸ)��
a��Y��������������Z��
b��Y������ˮ��Ӧ��Z������ˮ��Ӧ����
c��Y����������Ӧ��ˮ����ļ��Ա�Z��ǿ
��3��д��X�γɵ��ʵĵ���ʽ_________________������Ԫ�ط��ű�ʾ��
��4��T�����γ��ȶ���������Tm-��Y�����γ��ȶ���������Yn+����뾶��ϵΪr(Tm-) ______ r��Yn+�����>��,��<����=����
��5��X��Y��Z������������Ӧ��ˮ��������������Ӧ��д��Y��Z������������Ӧ��ˮ����֮�䷴Ӧ�����ӷ���ʽ___________________________��
���𰸡� ![]() a
a ![]() > Al(OH)3+OH-=AlO2-+2H2O
> Al(OH)3+OH-=AlO2-+2H2O
��������T�����������Ǵ�����������3��, ��TΪOԪ�أ�X�������������۵Ĵ�����Ϊ2�������µ���Ϊ���壬����XΪNԪ�أ�YԪ�ص�ԭ�Ӻ���M���K����1�����ӣ���![]() ����YΪNaԪ�أ�Z�ǵ������ڽ��������а뾶��С�ģ�����ZΪAlԪ�ء�(1)OԪ�ص�ԭ�ӽṹʾ��ͼΪ
����YΪNaԪ�أ�Z�ǵ������ڽ��������а뾶��С�ģ�����ZΪAlԪ�ء�(1)OԪ�ص�ԭ�ӽṹʾ��ͼΪ![]() ��
��
(2)�����������Ķ��ٲ���֤�������Ե�ǿ������a����Na��ˮ��Ӧ��Al��ˮ��Ӧ���ң�֤��Na�Ľ����Ա�Al��ǿ����b��ȷ��NaOH �ļ���ǿ��Al(OH)3�ģ�֤��Na�Ľ����Ա�Al��ǿ����c��ȷ�������ȷ��Ϊa��
(3)�����ĵ���ʽΪ![]() ��
��
(4)O2����Na+������ͬ�ĵ��Ӳ�ṹ�����˵����O2��С��Na+���������Ӱ뾶Ϊr(O2��)> r(Na+)��
(5)Y��Z������������Ӧ��ˮ����ֱ���NaOH��Al(OH)3�����߷�Ӧ�����ӷ���ʽΪAl(OH)3+OH-=AlO2-+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����ȡ����Ӧ����
A.�Ҵ��ڿ�����ȼ��
B.���������£�����������������Ӧ
C.��ϩʹ������Ȼ�̼��Һ��ɫ
D.�����������������£���������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ�ص�ԭ���������2�����ӣ����Ԫ����(����)
A.����Ԫ��B.ϡ������Ԫ��
C.����A��Ԫ��D.��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ���������ֵ������˵����ȷ����
A. 6.0gSiO2���0.1NA��SiO2����
B. ��״��������1L�ܱ������г���46gNO2�����������еķ�����ΪNA
C. ����������ˮ��Ӧ,ÿ����0.1mol������ת�Ƶ��ӵ���ĿΪ0.4NA
D. ���³�ѹ����7.0g�ɶ�ϩ���ϩ��ɵĻ�����к�����ԭ�ӵ���ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��ѧ���ڻ�ѧ��Ӧ�������ԭ�Ӿ�������(ԭ�ӽ�Լ)���¸��Ҫ�������ԭ�Ӿ����Է�Ӧ��ԭ�Ϸ����е�ԭ��ȫ��ת��������Ҫ�IJ�������������ʵ�����ŷš����з�Ӧ��������ȫ����Ҫ�����(����)
A. �ֽⷴӦ B. ȡ����Ӧ C. ���ֽⷴӦ D. ���Ϸ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1molH-HҪ���յ�����Ϊ436kJ���γ�1molH-N�ų�391kJ�������������Ľṹ��ͼ�����ݻ�ѧ����ʽN2��3H2 ![]() 2NH3��1molN2��3molH2��Ӧʱ����92kJ�������1molN��N����Ҫ������Ϊ ( ��
2NH3��1molN2��3molH2��Ӧʱ����92kJ�������1molN��N����Ҫ������Ϊ ( ��
A. 431kJ B. 698kJ C. 946kJ D. 394kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ȡ�����ʵ�����MgO��Fe2O3�Ļ����������ȷ�Ӧ,��Ӧ�Ļ�ѧ����ʽΪ________,�������ȷ�Ӧ��ʵ�������____��
��2���������ڱ��Խ��߹�����Be��Al���ʼ��仯�����������ơ�д��Be��NaOH��Һ��Ӧ����Na2 [Be(OH) 4]�����ӷ���ʽ__________________��
��3��5��4gijԪ��R�ĵ��������������ᷴӦ������RCl3��6.72L����,R������������������1������R��ԭ�ӷ���Ϊ______________��R������������ǿ������ӷ���ʽ______________��
��4��ʵ���Ҳ����ô��������Լ�ƿװNaOH��Һ���û�ѧ����ʽ�ͼ�Ҫ����˵��_____________��
��5����Ϊ�������������ҽ���Ϻ������ӣ�����ԭ��������____��ȡ1mol�����3.5mol������һ�ܱ������ڳ�ַ�Ӧ������������1.5mol�ķ���ͬʱ�а�ɫ�������� ���˰�ɫ����Ļ�ѧʽΪ_________��
��6����Ҫʹ1mol CH4��ȫ��Cl2����ȡ����Ӧ����������ͬ���ʵ���������ȡ�����������HCl�����ʵ���Ϊ________��
A��5 mol B��4mol
C��2.5mol D��1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ����ȷ����
A. 25��ʱ,AgBr��0.01mol/L��MgBr2��Һ��NaBr��Һ�е��ܽ����ͬ
B. NaCN��Һ�������ϳ����Ե���Һ��:c(Na+)>c(Cl-)=c(HCN)
C. 25��ʱ����0.01mol/L�Ĵ�����Һ��ˮ����ϡ�ͣ�  ��С
��С
D. Na2CO3��NaHCO3��Һ��Ũ�ȵ������Ϻ�: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ���г�����Ӧ������ȷ���ǣ� ��
ʵ����ʵ | ���� | |
�� | ͭ����������ɫ�ij�Ϊͭ�� | ͭ�������ܵ�����Ĥ |
�� | Ũ����ɳ�ȥ��ƿ�ڲ�����MnO2 �� ϡ����ɳ�ȥ�Թ��ڱڵ���������ĥ�ڲ���ƿ����NaOH��Һ | ��������������ԭ��Ӧ |
�� | ����CO2ͨ��Na[Al��OH��4]��Һ������ɫ������Na2CO3 | ���ԣ�HCO3����Al��OH��3 |
�� | ij��Һ����ϡ���������ʹ����ʯ��ˮ����ǵ���ɫ��ζ���壬����Һ�μ�CaCl2��Һ���а�ɫ�������� | ȷ������Һ����CO |
�� | ij��ɫ��Һ�м���Ũ����������Һ�����ȣ�������������ʹʪ���ɫʯ����ֽ���� | ����Һһ����NH |
A.�ڢۢ�
B.�٢ڢ�
C.�ۢܢ�
D.ȫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com