
【题目】有一氢气和氯气的混合气体,经点燃并充分燃烧,然后将气体冷却,并用 200mL 4.00mol·L-1 的 NaOH 溶液恰好完全吸收,测得溶液中含有 ClO-的物质的量为 0.1mol。
(1)所得溶液中 Cl-的物质的量为_________mol;
(2)原混合气体中氢气和氯气的物质的量比为_____________。
【答案】 0.7 3∶4
【解析】(1)所得溶液中为NaCl和NaClO的混合物,根据电荷守恒可知n(Na+)=n(Cl-)+n(ClO-),则n(Cl-)=n(Na+)-n(ClO-)=0.2L×4mol/L-0.1mol=0.7mol,故答案为:0.7;
(2)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO)=0.1mol,与H2反应的Cl2为n(Cl2)= ![]() ×[n(Cl-)-n(NaClO)]=
×[n(Cl-)-n(NaClO)]= ![]() ×(0.7mol-0.1mol)=0.3mol=n(H2),原混合气体中氢气和氯气的物质的量比为0.3mol:(0.1mol+0.3mol)=3:4,故答案为:3:4。
×(0.7mol-0.1mol)=0.3mol=n(H2),原混合气体中氢气和氯气的物质的量比为0.3mol:(0.1mol+0.3mol)=3:4,故答案为:3:4。


科目:高中化学 来源: 题型:
【题目】(10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 ,其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为1.0 L的恒容密闭容器中仅发生反应:CH3OH(g)+CO(g)![]() CH3COOH(g) ΔH<0。下列说法正确的是( )
CH3COOH(g) ΔH<0。下列说法正确的是( )

A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为3∶4
B. 达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
D. 达平衡时,容器Ⅰ中CH3OH转化率与容器Ⅲ中CH3COOH转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是_________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________________。
(4)过程Ⅲ实验的目的是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 在酸性溶液中易被还原成
在酸性溶液中易被还原成![]() ,且
,且![]() 、
、![]() 、
、![]() 、
、![]() 的氧化性依次减弱。下列叙述中,正确的是
的氧化性依次减弱。下列叙述中,正确的是
A. ![]() 通入
通入![]() 溶液中,可存在反应3
溶液中,可存在反应3![]() +6
+6![]() ====2
====2![]() +4
+4![]()
B. 每1 mol ![]() 在酸性溶液中被氧化生成
在酸性溶液中被氧化生成![]() 时转移2 mol
时转移2 mol ![]()
C. ![]() 溶液能将KI溶液中的I-氧化
溶液能将KI溶液中的I-氧化
D. I2具有较强的氧化性,可以将![]() 氧化成
氧化成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰氧基胡椒酚乙酸酯(F)具有抗氧化性、抗肿瘤作用,其合成路线如下:
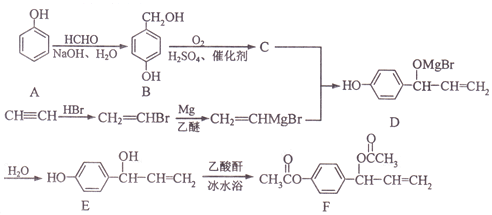
已知:RMgBr![]()
(1)化合物F中含氧官能团的名称为______。
(2)A-B的反应类型为_______。
(3)化合物C的结构简式为______。
(4)1mol化合物E与足量乙酸酐[(CH3CO)2O]反应,除F外另一产物的物质的量为_______。
(5)写出同时满足下列条件的E的一种同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应;
③核磁共振氢谱显示有4种不同化学环境的氢,其峰面积比为6:2:1:1。
(6)请以甲苯和乙醛为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是一种常用的治感冒药,其结构简式如图所示,下列有关阿司匹林的说法正确的是

A. 1mol阿司匹林最多能与5mol H2反应
B. 1mol阿司匹林最多能与1molNaHCO3反应
C. 1mol阿司匹林最多能与2mol NaOH反应
D. 1mol阿司匹林与足量的Na反应生成ImolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |

(1)制备NaN3:
30℃时,水合肼(N2H4H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2)测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I- ![]() I2
I2 ![]() S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com