


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题

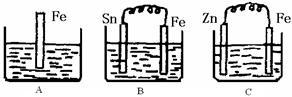
| A.装置①中阳极上析出红色固体 |
| B.装置②中铜片应与电源负极相连 |
| C.装置③中外电路电流方向:b极 →a极 |
| D.装置④中阴极反应:2 Cl--2e-= Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
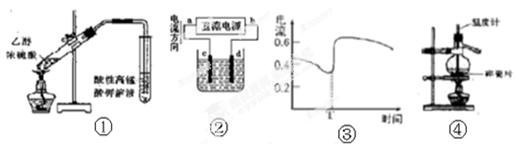
| A.装置①检验加热时产生的乙烯 |
| B.装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液。 |
| C.图③表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2 |
| D.装置④分离溴的四氯化碳溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.煤、石油和天然气都是可再生的能源 |
| B.目前使用的手机电池为二次电池,放电时是将化学能转化为电能 |
| C.人体运动所消耗的能量与化学反应无关 |
| D.人类目前所直接利用的能量大部分是由化学反应产生的 |
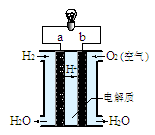
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.① | B.①②④ | C.①②③ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
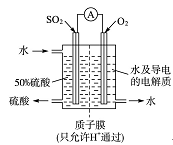
 2PbSO4+2H2O
2PbSO4+2H2O| A.充电时阴极反应为:Pb + SO42- -2e- =PbSO4 |
| B.放电时,当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为1mol |
| C.放电时溶液中H+向负极移动 |
| D.充电时阳极附近溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
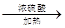 CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 (填答案编号)。
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 (填答案编号)。

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
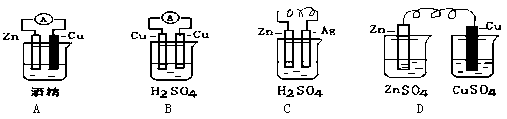
| A.金属的电化腐蚀和化学腐蚀本质相同,但电化腐蚀伴有电流产生 |
| B.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈 |
| C.钢铁发生析氢腐蚀时,正极发生的电极反应为:Fe-2e-®Fe2+ |
| D.埋在地下的钢管与电源正极连接可以减缓腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com