
【题目】下列各组离子因发生氧化还原反应而不能大量共存的是( )
A.Fe3+、OH-、SO42-、CO32-B.Cu2+、Fe3+、H+、I-
C.Ag+、Na+、SO42-、Cl-D.K+、H+、CO32-、MnO4-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。化学原理:CH2=CH2(g)+H2O(g)→CH3CH2OH(g)△H。已知几种共价键的键能如下表所示:
化学健 | C-H | C=C | H-O | C-C | C-O |
健能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是( )
A. 上述合成乙醇的反应是加成反应
B. 相同时间段内,反应中用三种物质表示的反应速率相等
C. 碳碳双键的键能小于碳碳单键键能的2倍
D. 上述反应式中,△H=-96kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
A.a=3
B.a=2
C.B的转化率为40%
D.B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是( )
2NH3(g)已达到平衡状态的是( )
①6个N—H键形成的同时,有3个H—H键断裂;②3个H—H键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,密度保持不变;⑦3v(N2)正 =v(H2)逆;⑧容器内A、B、C、D四者共存 ⑨NH3的生成速率与分解速率相等; ⑩A 、B、C的分子数目比为1:3:2。
A. 全部 B. ①③④⑤⑧ C. ②③④⑤⑦⑨ D. ①③⑤⑥⑦⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线: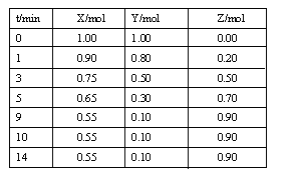
(2)体系中发生反应的化学方程式是;
(3)列式计算该反应在0-3min时间内产物Z的平均反应速率;
(4)该反应达到平衡时反应物X的转化率α等于;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如下图所示)。则曲线①、②、③所对应的实验条件改变分别是:① ②③。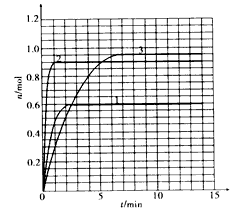
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的( )
A.硫酸铜溶液
B.硝酸钠溶液
C.醋酸钠溶液
D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CH2=CH2+ H2→CH3-CH3 , 有关化学键的键能如下: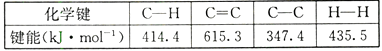
则该反应的反应热△H为( )
A.+288.8kJ/mo1
B.-703.4 kJ/mo1
C.+125.4kJ/mo1
D.-125.4 kJ/mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2 , 其工作原理如图所示。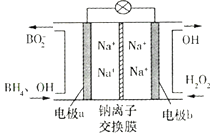
下列说法正确的是( )
A.电池放电时Na+从b极区移向a极区
B.电极a采用MnO2 , MnO2既作电极材料又有催化作用
C.每消耗1 mol H2O2 , 转移的电子为1 mol
D.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 固体SiO2一定是晶体
B. 晶体有固定的组成,非晶体没有固定的组成
C. 晶体内部的微粒按一定规律呈周期性有序排列
D. 冰和固体碘晶体中相互作用力相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com