
°æƒø°ø𧓵…œ£¨‘⁄“ª∂®Ãıº˛œ¬¿˚”√““œ©∫ÕÀÆ’Ù∆¯∑¥”¶÷∆±∏““¥º°£ªØ—ß‘≠¿Ì£∫CH2=CH2(g)+H2O(g)°˙CH3CH2OH(g)°˜H°£“—÷™º∏÷÷π≤º€º¸µƒº¸ƒÐ»Áœ¬±ÌÀ˘ æ£∫
ªØ—ßΩ° | C-H | C=C | H-O | C-C | C-O |
Ω°ƒÐ/kJ°§mol-1 | 413 | 615 | 463 | 348 | 351 |
œ¬¡–Àµ∑®¥ÌŒÛµƒ «£® £©
A. …œ ˆ∫œ≥…““¥ºµƒ∑¥”¶ «º”≥…∑¥”¶
B. œýÕ¨ ±º‰∂Œƒ⁄,∑¥”¶÷–”√»˝÷÷ŒÔ÷ ±Ì 浃∑¥”¶ÀŸ¬ œýµ»
C. úúÀ´º¸µƒº¸ƒÐ–°”⁄úúµ•º¸º¸ƒÐµƒ2±∂
D. …œ ˆ∑¥”¶ Ω÷–,°˜H=-96kJ°§mol-1
°æ¥∞∏°øD
°æΩ‚Œˆ°øA. …œ ˆ∫œ≥…““¥ºµƒ∑¥”¶ «º”≥…∑¥”¶£¨A’˝»∑£ªB. ∑¥”¶ªÏ∫œŒÔ÷–£¨∏˜ŒÔ÷ µƒªØ—ߺ∆¡ø ˝œýÕ¨£¨À˘“‘œýÕ¨ ±º‰∂Œƒ⁄£¨∑¥”¶÷–”√»˝÷÷ŒÔ÷ ±Ì 浃∑¥”¶ÀŸ¬ œýµ»£¨B’˝»∑£ªC. ”…Â÷– ˝æðø…÷™£¨ÃºÃºÀ´º¸µƒº¸ƒÐ–°”⁄úúµ•º¸º¸ƒÐµƒ2±∂£¨C’˝»∑£ªD. …œ ˆ∑¥”¶ Ω÷–£¨°˜H=(615 kJ°§mol-1)+( 413 kJ°§mol-1) ![]() +( 463 kJ°§mol-1)
+( 463 kJ°§mol-1) ![]() °¡(348 kJ°§mol-1)-( 413 kJ°§mol-1)
°¡(348 kJ°§mol-1)-( 413 kJ°§mol-1) ![]() -(463 kJ°§mol-1)-( 351 kJ°§mol-1)=-34kJ°§mol-1£¨D≤ª’˝»∑£¨±æ—°D°£
-(463 kJ°§mol-1)-( 351 kJ°§mol-1)=-34kJ°§mol-1£¨D≤ª’˝»∑£¨±æ—°D°£


 ÃÏÃϜڅœ“ª±æ∫√æÌœµ¡–¥∞∏
ÃÏÃϜڅœ“ª±æ∫√æÌœµ¡–¥∞∏ –°—ß…˙10∑÷÷””¶”√Âœµ¡–¥∞∏
–°—ß…˙10∑÷÷””¶”√Âœµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øµÁΩ‚NaCl»Ð“∫µƒ◊∞÷√»ÁÕºÀ˘ 棨œ¬¡–Àµ∑®≤ª’˝»∑µƒ «£® £©
A.Ã˙µÁº´…œµƒµÁº´∑¥”¶ ΩŒ™Fe-2e-=Fe2+
B.»Ð“∫÷–Na+”… ؃´µÁº´œÚÃ˙µÁº´“∆∂Ø
C.Õ®µÁ“ª∂Œ ±º‰∫Û£¨ø…ø¥µΩÃ˙µÁº´∏ΩΩ¸»Ð“∫±‰∫Ï
D.Õ®µÁ“ª∂Œ ±º‰∫Û£¨ø…ø¥µΩ ‘πÐ÷–»Ð“∫±‰¿∂
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–”–πÿÃ˙—Œ»Ð“∫µƒ– ˆ£¨’˝»∑µƒ «
A. Fe2(SO4)3»Ð“∫÷–£∫K+°¢Fe2+°¢C6H5OH°¢Br-ø…“‘¥Û¡øπ≤¥Ê
B. Fe2(SO4)3»Ð“∫∫ÕBa(OH)2»Ð“∫∑¥”¶µƒ¿Î◊”∑Ω≥Ã Ω£∫Fe3++SO42-+Ba2++3OH-==Fe(OH)3°˝+BaSO4°˝
C. FeBr3»Ð“∫÷–µŒº”KI-µÌ∑€»Ð“∫±‰Œ™¿∂…´
D. FeBr3»Ð“∫”ÎœıÀ·À·ªØµƒAgNO3»Ð“∫∑¥”¶”–≥¡µÌ…˙≥…≤¢∑≈≥ˆ∆¯ÃÂ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø µ—È “ø…Õ®π˝∑¥”¶£ª3Cl2+6KOH![]() 5KCl+KC1O3+3H2O ÷∆»°KC1O3£¨‘Ÿ”√…‘≥± ™µƒKC1O3∫Õ≤ðÀ·(H2C2O4) ‘⁄60°Ê ±∑¥”¶÷∆»°ClO2∆¯Ã£¨◊∞÷√»ÁÕºÀ˘ æ°£ClO2 «“ª÷÷ª∆¬Ã…´”–¥Ãº§–‘∆¯Œ∂µƒ∆¯Ã£¨∆‰»€µ„Œ™-59°Ê£¨∑–µ„Œ™11.0°Ê£¨“◊»Ð”⁄ÀÆ°£
5KCl+KC1O3+3H2O ÷∆»°KC1O3£¨‘Ÿ”√…‘≥± ™µƒKC1O3∫Õ≤ðÀ·(H2C2O4) ‘⁄60°Ê ±∑¥”¶÷∆»°ClO2∆¯Ã£¨◊∞÷√»ÁÕºÀ˘ æ°£ClO2 «“ª÷÷ª∆¬Ã…´”–¥Ãº§–‘∆¯Œ∂µƒ∆¯Ã£¨∆‰»€µ„Œ™-59°Ê£¨∑–µ„Œ™11.0°Ê£¨“◊»Ð”⁄ÀÆ°£
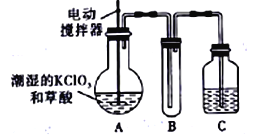
«Îªÿ¥œ¬¡–Œ £∫
£®1£©A ÷–∑¥”¶µƒ÷˜“™≤˙ŒÔ”–£∫ƒ≥÷÷’˝—Œ°¢ClO2∫ÕCO2µ»£¨–¥≥ˆ∏√∑¥”¶µƒªØ—ß∑Ω≥Ã Ω£∫_______________________________°£
£®2£©«Î∑÷Œˆ◊∞÷√Õº£¨Ω¯––≤π≥‰∫ÕÕÍ…∆°£A≤ø∑÷»±___________◊∞÷√£¨B≤ø∑÷ªπ”¶≤π≥‰____________◊∞÷√£¨ªπ”–“ª¥¶…˺∆√˜œ‘≤ª∫œ¿Ìµƒ «___________£®ÃÓ°∞A°±°∞B°±ªÚ°∞C°±£©
£®3£©C÷–µƒ ‘º¡Œ™NaOH»Ð“∫ ±£¨∑¥”¶…˙≥…NaClO3∫ÕNaClO2£¨–¥≥ˆ∏√∑¥”¶µƒ¿Î”⁄∑Ω≥Ã Ω£∫______________________________________°£
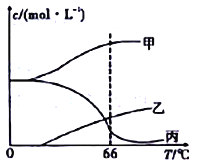
£®4£©‘⁄√б’»ð∆˜÷–œÚ9°ÊµƒKOH»Ð“∫÷–Õ®»Î…Ÿ¡øCl2£¨¥À ±Cl2µƒ—ıªØ≤˙ŒÔ÷˜“™ «______________£ªºÃ–¯Õ®»Î ¡øCl2£¨Ω´»Ð“∫º”»»£¨»Ð“∫÷–÷˜“™¿Î◊”µƒ≈®∂»ÀÊŒ¬∂»µƒ±‰ªØ»ÁÕºÀ˘ 棨պ÷–º◊°¢““°¢±˚“¿¥Œ±Ì 浃¿Î◊” «____________________£®≤ªøº¬«Cl2µƒª”∑¢£©
£®5£©≤‚∂®KClO3—˘∆∑÷–C1O3-µƒ∫¨¡ø£¨≥∆»°—˘∆∑ag£¨◊º»∑≈‰÷∆≥…1000mL»Ð“∫£¨¥”…œ ˆ»Ð“∫÷–»°≥ˆ10.00mL ”⁄◊∂–Œ∆ø÷–£¨◊º»∑º”»Î30.00mL 1.00 molL-1 (NH4)2Fe(SO4)2»Ð“∫£®π˝¡ø£©°£‘Ÿ‘⁄◊∂–Œ∆ø÷–º”»Î100mL ’Ù¡ÛÀƺ∞ƒ≥÷÷÷∏ 溡£¨”√0.200 molL-1K2Cr2O7±Í◊º»Ð“∫µŒ∂®÷¡÷’µ„£¨œ˚∫ƒ5.00mL°£—˘∆∑÷–C1O3-µƒ÷ ¡ø∑÷ ˝Œ™_________°££®“—÷™Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O£¨C1O3-ø…±ªFe2+ªπ‘≠Œ™Cl-£©
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–– ˆ’˝»∑µƒ «
A.«‚∆¯µƒƒ¶∂˚÷ ¡ø «2g/mol
B.±Í◊º◊¥Ã¨œ¬22.4LÀƵƒŒÔ÷ µƒ¡ø «1mol
C.≥£Œ¬≥£—πœ¬«‚∆¯µƒƒ¶∂˚ê˝ «22.4L/mol
D.≥£Œ¬≥£—πœ¬16gO2µƒŒÔ÷ µƒ¡ø «1mol
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒ≥Œ¬∂»‘⁄√б’»ð∆˜∑¢…˙£∫3H2(g)£´N2(g) ![]() 2NH3(g)£¨»Ùø™ º ±÷ª≥‰»Î2 mol NH3 (g)£¨¥Ô∆Ω∫‚ ±£¨ªÏ∫œ∆¯Ãµƒ∆Ωæ˘ƒ¶∂˚÷ ¡øµ»”⁄10. 625g/moL£ª»Ùø™ º ±÷ª≥‰»Î3mol H2∫Õ1 mol N2µƒªÏ∫œ∆¯Ã£¨¥Ô∆Ω∫‚ ±H2µƒ◊™ªØ¬ Œ™£® £©
2NH3(g)£¨»Ùø™ º ±÷ª≥‰»Î2 mol NH3 (g)£¨¥Ô∆Ω∫‚ ±£¨ªÏ∫œ∆¯Ãµƒ∆Ωæ˘ƒ¶∂˚÷ ¡øµ»”⁄10. 625g/moL£ª»Ùø™ º ±÷ª≥‰»Î3mol H2∫Õ1 mol N2µƒªÏ∫œ∆¯Ã£¨¥Ô∆Ω∫‚ ±H2µƒ◊™ªØ¬ Œ™£® £©
A.20%
B.40%
C.60%
D.80%
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡– µ—È≤Ÿ◊˜∫Õ∂‘”¶µƒ¿Î◊”∑Ω≥à Ω∂º’˝»∑µƒ «£® £©
—°œÓ | µ—È≤Ÿ◊˜ | ¿Î◊”∑Ω≥Ã Ω |
A | œÚ‰ÂªØ—«Ã˙»Ð“∫÷–µŒº”¬»ÀÆ,÷§√˜ªπ‘≠–‘£∫Fe2+>Br- | Cl2+2Br-=Br2+2Cl- |
B | ”√≥Œ«Â ت“Àƺ¯±K2SO3»Ð“∫∫ÕKHSO3»Ð“∫ | Ca2++SO32-=CaSO3°˝ |
C | ”√±•∫ÕNa2CO3»Ð“∫Ω˛≈ð ‘πÐ÷–µƒ¡ÚÀ·∏∆ | CaSO4+CO32- |
D | œÚAl2(SO4)3»Ð“∫÷–µŒº”∞±ÀÆ÷∆±∏«‚—ıªØ¬¡ | Al3++3OH-=Al(OH)3°˝ |
A. A B. B C. C D. D
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øª“Œ˝(“‘∑€ƒ©◊¥¥Ê‘⁄)∫Õ∞◊Œ˝ «Œ˝µƒ¡Ω÷÷Õ¨Àÿ“Ï–ŒÃ°£“—÷™£∫
¢ŸSn (s°¢∞◊)£´2HCl (aq)£ΩSnCl2 (aq)£´H2 (g)£ªDH1
¢⁄Sn (s°¢ª“)£´2HCl (aq)£ΩSnCl2 (aq)£´H2 (g)£ªDH2
¢€Sn (s°¢ª“) Sn (s°¢∞◊)£ªDH3£Ω£´2.1 kJ/mol
Sn (s°¢∞◊)£ªDH3£Ω£´2.1 kJ/mol
œ¬¡–Àµ∑®’˝»∑µƒ «( )
A. DH1£æDH2
B. Œ˝‘⁄≥£Œ¬œ¬“‘ª“Œ˝◊¥Ã¨¥Ê‘⁄
C. ª“Œ˝◊™ªØŒ™∞◊Œ˝µƒ∑¥”¶ «∑≈»»∑¥”¶
D. Œ˝÷∆∆˜√Û≥§∆⁄¥¶”⁄µÕ”⁄13.2 °Êµƒª∑æ≥÷–£¨ª·◊‘––ªŸªµ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–∏˜◊È¿Î◊”“Ú∑¢…˙—ıªØªπ‘≠∑¥”¶∂¯≤ªƒÐ¥Û¡øπ≤¥Êµƒ «(°°°°)
A.Fe3£´°¢OH-°¢SO42-°¢CO32-B.Cu2£´°¢Fe3£´°¢H£´°¢I-
C.Ag£´°¢Na£´°¢SO42-°¢Cl-D.K£´°¢H£´°¢CO32-°¢MnO4-
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com