
����Ŀ������ʵ������Ͷ�Ӧ�����ӷ���ʽ����ȷ������ ��
ѡ�� | ʵ����� | ���ӷ���ʽ |
A | ���廯������Һ�еμ���ˮ,֤����ԭ�ԣ�Fe2+>Br- | Cl2+2Br-=Br2+2Cl- |
B | �ó���ʯ��ˮ����K2SO3��Һ��KHSO3��Һ | Ca2++SO32-=CaSO3�� |
C | �ñ���Na2CO3��Һ�����Թ��е������ | CaSO4+CO32- |
D | ��Al2(SO4)3��Һ�еμӰ�ˮ�Ʊ��������� | Al3++3OH-=Al(OH)3�� |
A. A B. B C. C D. D
���𰸡�C
��������A. ���廯������Һ�еμ���������ˮ����֤����ԭ��Fe2+>Br-����Ϊ������ˮ�����������������ǰ���������������Һ���ɱ�Ϊ��ɫ���ʸ�ʵ����ԭ�����Dz����еģ�Ӧ���ԸĽ����ټ����Ȼ�̼��������۲쵽�²��Ϊ�Ⱥ�ɫ������֤�����÷�Ӧ�����ӷ���ʽΪ Cl2+2Fe2+=2Fe3++2Cl-��A����ȷ�� B. �ó���ʯ��ˮ���ܼ���K2SO3��Һ��KHSO3��Һ����Ϊ���Ǿ�����ʯ��ˮ��Ӧ����CaSO3������B����ȷ��C. �ñ���Na2CO3��Һ�����Թ��е���������÷�Ӧ�����ӷ���ʽΪCaSO4+CO32-![]() CaCO3+SO42-��C��ȷ��D. ��Al2(SO4)3��Һ�еμӰ�ˮ�Ʊ������������÷�Ӧ�����ӷ���ʽ����ȷ��һˮ�ϰ��������������������ʾ������ѡC��
CaCO3+SO42-��C��ȷ��D. ��Al2(SO4)3��Һ�еμӰ�ˮ�Ʊ������������÷�Ӧ�����ӷ���ʽ����ȷ��һˮ�ϰ��������������������ʾ������ѡC��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β����NO�����ķ�ӦΪ��N2��g��+O2��g��2NO��g����һ�������£������ʵ�����N2��g����O2��g���ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ� �� 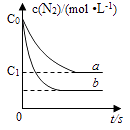
A.�¶�T�£��÷�Ӧ��ƽ�ⳣ��K= ![]()
B.�¶�T�£����ŷ�Ӧ�Ľ��У����������ܶȼ�С
C.����b��Ӧ�������ı�����Ǽ����˴���
D.������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ�ġ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����I��LiH�����ɴ���ȼ�ϣ���֪���з�Ӧ��
��2Li(s)+H2(g)===2LiH(s) ��H��-182 kJ��mol-1��
��2H2(g)+O2(g)===2H2O(l) ��H��-572 kJ��mol-1��
��4Li(s)+O2(g)===2Li2O(s) ��H��-1196 kJ��mol-1��
��д��LiH��O2��ȼ�յ��Ȼ�ѧ����ʽ��__________________________________________��
��II������H2��CO2�����״���ij�¶��£����ݻ�Ϊ2L���ܱ������г���1molCO2��3.25mol H2����һ�������·�Ӧ�����CO2��CH3OH��g����H2O��g�������ʵ�����n����ʱ��ı仯��ϵ��ͼ��ʾ��
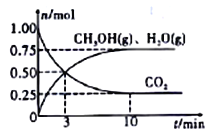
��1���ӷ�Ӧ��ʼ��3minʱ��������ƽ����Ӧ����v(H2)=____________��
��2�����д�ʩ��һ����ʹCO2��ת�����������_______________������ţ���
A.��ԭ�������ٳ���1mol CO2 B.��ԭ�������ٳ���1mol H2
C.��ԭ�������ٳ���1mol He D.ʹ�ø���Ч�Ĵ���
E. ��С�������ݻ� F. ��ˮ��������ϵ�з����
��III��ͼ�Ǽ״�ȼ�ϵ�ع�����ʾ��ͼ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��
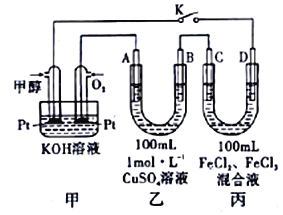
��1�����и����ĵ缫��ӦʽΪ_______________________________��
��2������A�������������ڱ�״���µ����Ϊ_______________________��
��IV����֪������CN-��ˮ�ⳣ��Kb=1.61��10-5��
��1�������£��������ʵ���Ũ�ȵ�HCN��NaCN�Ļ����Һ��_________����ᡱ������С����ԣ�c(CN-)_______���>����<����=����c(HCN)��
��2�������£�����c molL-1������0.61 molL-1KCN��Һ�������Ϻ�ǡ�õõ�������Һ����c=________��С�������4λ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϣ���һ��������������ϩ��ˮ������Ӧ�Ʊ��Ҵ�����ѧԭ����CH2=CH2(g)+H2O(g)��CH3CH2OH(g)��H����֪���ֹ��ۼ��ļ������±���ʾ��
��ѧ�� | C-H | C=C | H-O | C-C | C-O |
����/kJ��mol-1 | 413 | 615 | 463 | 348 | 351 |
����˵����������� ��
A. �����ϳ��Ҵ��ķ�Ӧ�Ǽӳɷ�Ӧ
B. ��ͬʱ�����,��Ӧ�����������ʱ�ʾ�ķ�Ӧ�������
C. ̼̼˫���ļ���С��̼̼�������ܵ�2��
D. ������Ӧʽ��,��H=-96kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���ˮ��Һ���ܴ������棬����ɫ������
A.Na+��Ba2+��NO3-��CO32-B.Cu2+��HCO3-��C1-��K+
C.Na+��K+��HCO3-��SO42��D.OH-��Cl-��Na+��Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.����һ����Դ�Ͷ�����Դ�Ļ��֣�����Ϊ������Դ
B.�������ִ������Ӧ����㷺��ʹ����㡢��Ⱦ��С��һ�ֶ�����Դ
C.����ǽ�ȼ���еĻ�ѧ��ֱ��ת��Ϊ���ܵĹ���
D.�ڻ�������ʱ����ѧ��ת��Ϊ���ܵĹ���ʵ������������ԭ��Ӧ�����Ĺ��̣������������ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯����������������й㷺Ӧ�á�
��1�����õ�����Һ����Ӿ���е�ˮ����������ˮ��Һ������,�����ӷ���ʽ��ʾ��ԭ��________________________________________________________________________________��
��2����Cu(OH)2����Һ�еμӰ�ˮ����ɫ���������ɫ��Һ����֪��Ksp[Cu(OH)2]=2.2��10-20��Cu2+(aq)+4NH3(aq)![]() [Cu(NH3)4]2+(aq)K1=2.0��1013����
[Cu(NH3)4]2+(aq)K1=2.0��1013����
Cu(OH)2(s)+4NH3(aq)![]() [Cu(NH3)4]2+(aq)+2OH-(aq)K2=_____________��
[Cu(NH3)4]2+(aq)+2OH-(aq)K2=_____________��
��3��Cu(OH)2����Ũ�ռ���Һ����Na2CuO2,��Na2CuO2��Һ�еμ�CuCl2��Һ,���ܹ۲쵽��������______________________________________________________________________________��
��4������������ͭ(Cu2O)������������ҵ�Ͽ��õ�ⷨ�Ʊ�,װ����ͼ��ʾ��
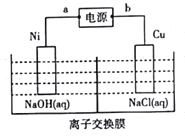
��a��������_________________;�����ķ�ӦʽΪ___________________��
��������������1mol����ͨ������Ĥ,���Ʊ�Cu2O������Ϊ_____________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2 mol A��3 mol B����һ�ܱ������У�������Ӧ��aA(g)��B(g) ![]() C(g)��D(g),5 min��ﵽƽ�⣮��֪���¶�����ƽ�ⳣ��K��1�����¶Ȳ���ʱ���������������Ϊԭ����10����A��ת���ʲ������仯���� ��
C(g)��D(g),5 min��ﵽƽ�⣮��֪���¶�����ƽ�ⳣ��K��1�����¶Ȳ���ʱ���������������Ϊԭ����10����A��ת���ʲ������仯���� ��
A.a��3
B.a��2
C.B��ת����Ϊ40%
D.B��ת����Ϊ60%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦCH2=CH2+ H2��CH3-CH3 �� �йػ�ѧ���ļ������£�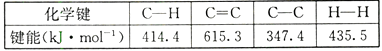
��÷�Ӧ�ķ�Ӧ�ȡ�HΪ�� ��
A.+288.8kJ/mo1
B.-703.4 kJ/mo1
C.+125.4kJ/mo1
D.-125.4 kJ/mo1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com