
下列说法正确的是( )
A.把100 mL 3 mol/L的H2SO4跟100 mL 水混合,硫酸的物质的量浓度变为1.5 mol/L
B.把200 mL 3 mol/L的BaCl2溶液跟100 mL 3 mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol/L
C.把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
D.把100 mL 1 mol/L的NaOH溶液取出10 mL后,NaOH溶液的浓度减小。
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
下列实验与对应的图象符合的是
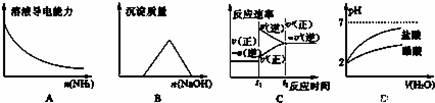
A.向一定量的CH3COOH溶液中通入NH3至过量
B.向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量
C.对于达到平衡状态的N2(g)+3H2(g)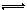 2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡
2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡
D.将pH=2的盐酸和醋酸分别加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
高炉炼铁过程中发生的主要反应为:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
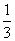 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
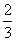 Fe(s)+CO2(g).
Fe(s)+CO2(g).
该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K= ,
ΔH 0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各
1.0 mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率
v(CO2)= ,CO的平衡转化率= ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是( )
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关的叙述正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
D.“血液透析”原理与胶体的性质无关
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)⇌2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时消耗1.5amol B;
③各组分的浓度不再变化;
④混合气体的密度不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦混合气体的平均摩尔质量不再变化;
⑧A、B、C的分子数目比为2:3:2.
|
| A. | ⑤⑥⑧ | B. | ②⑤⑧ | C. | ①③④ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是( )
|
| A. | 此时水的离子积Kw=1×10﹣12 | B. | 水电离出的c(H+)=1×10﹣12mol/L |
|
| C. | 水的电离程度随温度升高而增大 | D. | c(Na+)=c(SO42﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用碱式滴定管量取0.1mol/L的NaOH溶液,开始时仰视液面,读数为11.00mL,取出部分溶液后,俯视液面,读数为19. 00mL,实际取出液体的体积是
A.大于8.00mL B.小于8.00mL C.等于8. 00mL D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com