
100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是( )
|
| A. | 此时水的离子积Kw=1×10﹣12 | B. | 水电离出的c(H+)=1×10﹣12mol/L |
|
| C. | 水的电离程度随温度升高而增大 | D. | c(Na+)=c(SO42﹣) |
| 溶液pH的定义;离子积常数.. | |
| 专题: | 电离平衡与溶液的pH专题. |
| 分析: | A、计算出pH=6的蒸馏水中氢离子浓度,根据水的离子积表达式及蒸馏水中c(H+)=c(OH﹣)计算出水的离子积; B、硫酸氢钠电离的氢离子抑制了水的电离,溶液中氢氧根离子是水电离的; C、水的电离是吸热反应,温度升高,水的电离程度增大; D、根据物料守恒判断钠离子与硫酸根离子浓度关系. |
| 解答: | 解:A、蒸馏水的pH=6,说明c(H+)=c(OH﹣)=1×10﹣6mol•L﹣1,水的离子积Kw=1×10﹣12,故A正确; B、水电离出来的氢离子的浓度等于溶液中氢氧根的浓度,c(H+)=c(OH﹣)= C、由于水的电离过程为吸热反应,升高温度,促进了水的电离,水的电离程度会增大,故C正确; D、NaHSO4晶体中钠离子与硫酸根离子的物质的量相等,钠离子和硫酸根离子数目没有发生变化,根据物料守恒,溶液中(Na+)=c(SO42﹣),故D正确; 故选B. |
| 点评: | 本题考查了水的电离,题目难度中等,注意水的离子积常数与溶液的温度有关,明确影响水的电离的因素即可解答,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养. |


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
已知:H+(aq) + OH-(aq) ═ H2O(aq) ΔH= -57.3kJ/mol,下列说法正确的是( )
A.NaOH稀溶液分别与稀盐酸和稀醋酸反应生成1 mol H2O ,放出热量相同
B.稀盐酸分别与NaOH稀溶液和稀氨水反应生成1 mol H2O ,放出热量相同
C.Ba(OH)2稀溶液分别与稀盐酸和稀硫酸反应生成1 mol H2O ,放出热量不同
D.该反应说明有水生成的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.把100 mL 3 mol/L的H2SO4跟100 mL 水混合,硫酸的物质的量浓度变为1.5 mol/L
B.把200 mL 3 mol/L的BaCl2溶液跟100 mL 3 mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol/L
C.把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
D.把100 mL 1 mol/L的NaOH溶液取出10 mL后,NaOH溶液的浓度减小。
查看答案和解析>>
科目:高中化学 来源: 题型:
在NH3•H2O⇌NH4++OH﹣形成的平衡中,要使NH3•H2O的电离程度及c(OH﹣)都增大,可采取的措施是( )
|
| A. | 通入HCl | B. | 加少量NaOH固体 |
|
| C. | 加少量氯化铵固体 | D. | 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(H2N﹣NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N﹣N为154,则断裂1molN﹣H键所需的能量(kJ)是( )
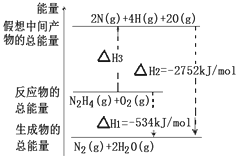
|
| A. | 194 | B. | 391 | C. | 516 | D. | 658 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)肼(N2H4)是发射航天飞船常用的高能燃料.将NH3和NaClO按一定物质的量比混合反应,生成肼、NaCl和水,该反应的化学方程式是 2NH3+NaClO=N2H4+NaCl+H2O .
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量气体,并放出大量热.已知:H2O(l) H2O(g)△H=+44kJ/mol.12.8g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量.
①请写出液态肼与过氧化氢反应生成液态水的热化学方程式 .
②则16g 液态肼与足量过氧化氢反应生成液态水时放出的热量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与胶体性质无关的是
A.可用半透膜除去淀粉溶液中的少量NaCl
B.黄河入海口容易形成沙洲
C.将植物油倒入水中用力搅拌可形成油水混合物
D.一束平行光线通过蛋白质溶液,从侧面可以看到一条光亮的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KClO3,且 的值与温度高低有关。当n(KOH) = a mol时,下列有关说法错误的是
A.参加反应的氯气的物质的量等于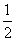 a mol
a mol
 B.若某温度下,反应后 =11,则溶液中 =
B.若某温度下,反应后 =11,则溶液中 = 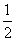
C. 改变温度,产物中KC1O3的最大理论产量为 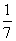 a mol
a mol
D.改变温度,反应中转移电子的物质的量ne的范围: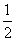 a mol ≤ ne ≤
a mol ≤ ne ≤ 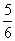 a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.1铁和铝的混合粉末溶于200mL、5mol/L的盐酸中,反应后盐酸的浓度变为4.6mol/L,若忽略溶液体积的变化,试计算:
(1)原混合物中铁和铝的质量各为多少?
(2)反应后产生的气体在标准状况下的体积多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com