
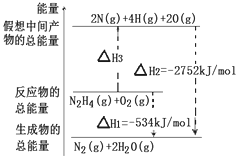
肼(H2N﹣NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N﹣N为154,则断裂1molN﹣H键所需的能量(kJ)是( )
|
| A. | 194 | B. | 391 | C. | 516 | D. | 658 |
| 化学能与热能的相互转化.. | |
| 专题: | 压轴题;化学反应中的能量变化. |
| 分析: | 根据热化学方程式的含义可知:旧键断裂所吸收的能量和新键生成所释放的能量之差即为化学反应焓变的数值,结合图示内容来回答即可. |
| 解答: | 解:根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),△H3=2752kJ/mol﹣534kJ/mol=2218kJ/mol, 设断裂1molN﹣H键所需的能量为K,即154+4K+500=2218,解得K=391. 故选B. |
| 点评: | 本题考查学生化学键的断裂和生成与反应的吸放热之间的关系,考查学生知识的灵活应用情况,难度不大. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:C(s)+O2(g)=CO2(g) △H=akJ·mol—1;
2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;
2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1.
方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备
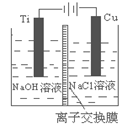 纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应
纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应
式为 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:
 ⊿H >0
⊿H >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)⇌2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时消耗1.5amol B;
③各组分的浓度不再变化;
④混合气体的密度不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦混合气体的平均摩尔质量不再变化;
⑧A、B、C的分子数目比为2:3:2.
|
| A. | ⑤⑥⑧ | B. | ②⑤⑧ | C. | ①③④ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在足量锌与等物质的量浓度、等体积的盐酸和醋酸反应时,下列叙述正确的是( )
|
| A. | 开始反应时,二者的速率相等 | B. | 盐酸放出的H2多 |
|
| C. | 二者放出的H2一样多 | D. | 醋酸消耗的Zn的质量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是( )
|
| A. | 此时水的离子积Kw=1×10﹣12 | B. | 水电离出的c(H+)=1×10﹣12mol/L |
|
| C. | 水的电离程度随温度升高而增大 | D. | c(Na+)=c(SO42﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:T℃、P kpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g)⇌C(g),平衡时C 的体积分数为40%.
(1)欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 ,C的体积分数为 .
(2)另取一个容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40%,则该密闭容器体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O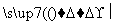 X+H2
X+H2
③Y+NaOH―→G+Q+H2O ④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )。
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制Cl2反应为4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O下列说法不正确的是( )
MnCl2+Cl2↑+2H2O下列说法不正确的是( )
A.还原剂是浓HCl,氧化剂是MnO2
B.每生成1mol Cl2,转移电子2mol
C.每消耗1mol MnO2,浓HCl被还原4mol
D.转移1mol电子时,生成的Cl2在标准状况下体积为11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com