
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O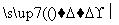 X+H2
X+H2
③Y+NaOH―→G+Q+H2O ④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )。
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在容积为1 L的密闭容器中,将CO和水蒸气的混合气体加热到800 ℃时,
有下列平衡CO(g)+H2O(g) 
 CO2(g)+H2(g),且K=1,若用2 mol CO
CO2(g)+H2(g),且K=1,若用2 mol CO
和10 mol H2O(g)相互混合并加热到800 ℃,则CO的转化率为( )
A.16.7% B.50% C.66.7% D.83.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
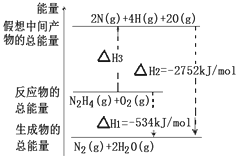
肼(H2N﹣NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N﹣N为154,则断裂1molN﹣H键所需的能量(kJ)是( )
|
| A. | 194 | B. | 391 | C. | 516 | D. | 658 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与胶体性质无关的是
A.可用半透膜除去淀粉溶液中的少量NaCl
B.黄河入海口容易形成沙洲
C.将植物油倒入水中用力搅拌可形成油水混合物
D.一束平行光线通过蛋白质溶液,从侧面可以看到一条光亮的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
绿原酸的结构简式如图,下列有关绿原酸的说法不正确的是
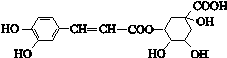
A.分子式为C16H18O9
B.能与Na2CO3反应
C.能发生取代反应和消去反应
D.0.1 mol绿原酸最多与0.8 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KClO3,且 的值与温度高低有关。当n(KOH) = a mol时,下列有关说法错误的是
A.参加反应的氯气的物质的量等于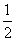 a mol
a mol
 B.若某温度下,反应后 =11,则溶液中 =
B.若某温度下,反应后 =11,则溶液中 = 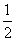
C. 改变温度,产物中KC1O3的最大理论产量为 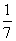 a mol
a mol
D.改变温度,反应中转移电子的物质的量ne的范围: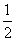 a mol ≤ ne ≤
a mol ≤ ne ≤ 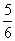 a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
Ⅰ. RCOOR’+ R’’18OH RCO18OR’’+R’OH(R、R’、R’’代表烃基)
RCO18OR’’+R’OH(R、R’、R’’代表烃基)
|
|
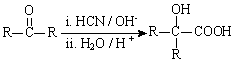 (R、R’代表烃基)
(R、R’代表烃基) (1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d. 1 mol 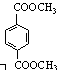 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯并生成B的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明的强酸性溶液中可以大量共存的离子组是( )
A.Na+、NO3-、Mg2+、Cl- B.Na+、CO32-、NO3-、Ca2+
C.K+、Cl-、SO42-、Cu2+ D.Ba2+、Cl-、K+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
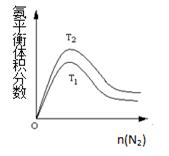 (2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),
判断的依据是: 。(3分)
(3)合成氨气所需的氢气可以由水煤气分离得到。
涉及反应信息如下:
反应一:C(s)+H2O(g)  H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1= 。(3分)
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为 。
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号) (3分)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com