
在容积为1 L的密闭容器中,将CO和水蒸气的混合气体加热到800 ℃时,
有下列平衡CO(g)+H2O(g) 
 CO2(g)+H2(g),且K=1,若用2 mol CO
CO2(g)+H2(g),且K=1,若用2 mol CO
和10 mol H2O(g)相互混合并加热到800 ℃,则CO的转化率为( )
A.16.7% B.50% C.66.7% D.83.3%
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
4NH3(g)+5O2(g)  4NO(g)+6H2O(g);ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
4NO(g)+6H2O(g);ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
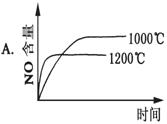
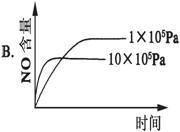
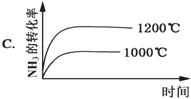
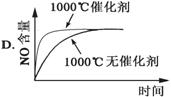
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:C(s)+O2(g)=CO2(g) △H=akJ·mol—1;
2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;
2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1.
方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备
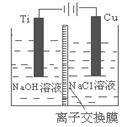 纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应
纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应
式为 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:
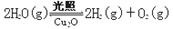 ⊿H >0
⊿H >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
相同体积、相同氢离子浓度的强酸溶液和弱酸溶液分别跟足量的镁完全反
应,下列说法正确的是( )
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较 两者产生氢气的量
查看答案和解析>>
科目:高中化学 来源: 题型:
高炉炼铁过程中发生的主要反应为:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
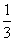 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
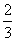 Fe(s)+CO2(g).
Fe(s)+CO2(g).
该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K= ,
ΔH 0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各
1.0 mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率
v(CO2)= ,CO的平衡转化率= ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是( )
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)⇌2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时消耗1.5amol B;
③各组分的浓度不再变化;
④混合气体的密度不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦混合气体的平均摩尔质量不再变化;
⑧A、B、C的分子数目比为2:3:2.
|
| A. | ⑤⑥⑧ | B. | ②⑤⑧ | C. | ①③④ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O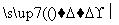 X+H2
X+H2
③Y+NaOH―→G+Q+H2O ④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )。
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com