
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��
N2(g)+3H2(g)  2NH3(g) ��H= -92.4 kJ/mol �ݴ˻ش��������⣺
2NH3(g) ��H= -92.4 kJ/mol �ݴ˻ش��������⣺
��1���ϳɰ���ҵ��ȡ�����д�ʩ�У���������ɳ����ԭ�����͵��� ������ţ���
�ٷ�ӦѹǿΪ20Mpa~50Mpa ��500��ĸ��� ������ý������
�ܽ����ɵİ�Һ������ʱ����ϵ�з��������δ��Ӧ��N2��H2ѭ�����ϳ����С�
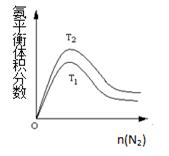 ��2��һ��������NH3��ƽ�����������n(N2)�仯��ͼ��ʾ(T-�¶�)����T2 T1(��>��=��<)��
��2��һ��������NH3��ƽ�����������n(N2)�仯��ͼ��ʾ(T-�¶�)����T2 T1(��>��=��<)��
�жϵ������ǣ� ����3�֣�
��3���ϳɰ������������������ˮú������õ���
�漰��Ӧ��Ϣ���£�
��Ӧһ��C(s)+H2O(g)  H2(g)+CO(g) �� ƽ�ⳣ��K1
H2(g)+CO(g) �� ƽ�ⳣ��K1
��Ӧ����CO(g)+H2O(g)  H2(g)+CO2(g) ƽ�ⳣ��K2
H2(g)+CO2(g) ƽ�ⳣ��K2
�� K1�ı���ʽ��K1�� ����3�֣�
�ڽ�һ������H2O(g)��CO(g)�ֱ�ͨ�뵽���Ϊ1L���ܱ������У��ڲ�ͬ�����½��з�Ӧ���õ������������ݣ�
| ʵ����� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
����ʵ��1�У���CO2��ʾ��Ӧ��ʼ��ƽ���ƽ����Ӧ����Ϊ ��
������ʵ��3����a��0.5��b��1ʱ��Ҫʹc��d������ʵ��2��ͬ����t��3�����Բ�ȡ�Ĵ�ʩΪ (�����) ��3�֣�
A���������������¶�T<900�� B���������������¶�T>900��
C������һ�������� D��ʹ�ø�Ч����
�����ڷ�Ӧ�����������¶�ʱK2 �����������С�����䡱����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪G��Q��X��Y��Z��Ϊ����Ԫ�صĻ������һ��������������ת����ϵ(δ��ƽ)��
��G�D��Q��NaCl�� ��Q��H2O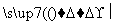 X��H2��
X��H2��
��Y��NaOH�D��G��Q��H2O�� ��Z��NaOH�D��Q��X��H2O
�����ֻ�������ClԪ�ػ��ϼ��ɵ͵��ߵ�˳����(����)��
A��G��Y��Q��Z��X B��X��Z��Q��G��Y
C��X��Z��Q��Y��G D��G��Q��Y��Z��X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ������Cl2��ӦΪ4HCl(Ũ)��MnO2 MnCl2��Cl2����2H2O����˵������ȷ����( )
MnCl2��Cl2����2H2O����˵������ȷ����( )
A.��ԭ����ŨHCl����������MnO2
B.ÿ����1mol Cl2��ת�Ƶ���2mol
C.ÿ����1mol MnO2��ŨHCl����ԭ4mol
D.ת��1mol����ʱ�����ɵ�Cl2�ڱ�״�������Ϊ11.2 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ᣨH2C2O4���Ƕ�Ԫ���ᣬ����������Һ�����ԡ���������10mL 0.01mol/L NaHC2O4��Һ�еμ�0.01mol/L NaOH��Һ������NaOH��Һ��������ӣ���Һ������Ũ�ȹ�ϵ��ȷ���� �� ��
A��V(NaOH) = 0ʱ��c(H��)=1��10��2mol/L
B��V(NaOH) <10mLʱ��һ������c(Na��)��c(C2O42��)��c(HC2O4�� )
C��V(NaOH) = 10 mLʱ��c(H��) = 1��10��7 mol/L
D��V(NaOH)��10 mLʱ��c(Na��)��c(C2O42��)��c(HC2O4�� )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��pH��3������a L�ֱ�������������Һ��Ϻ��Һ�������ԣ�
��1��10��3 mol��L��1�İ�ˮb L
��c(OH��)��1��10��3 mol��L��1�İ�ˮc L
��c(OH��)��1��10��3 mol��L��1��Ba(OH)2��Һd L
����a��b��c��d�Ĺ�ϵ��ȷ���� (����)
A��b��a��d��c B��a��b��c��d
C��a��b��d��c D��c��a��d��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ɫ��Һ������������������,����Һ�п��ܴ����������������(����)
A.H+��Ba2+��Mg2+��N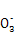 B.Cl-��C
B.Cl-��C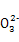 ��Cu2+��Mg2+
��Cu2+��Mg2+
C.N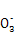 ��S
��S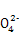 ��K+��OH- D.N
��K+��OH- D.N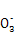 ��HC
��HC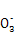 ��Ba2+��Cl-
��Ba2+��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������Fe��Cu�Ͻ���Ʒ����������ΪFe2O3��CuO����2.88g�������´�����

����˵����ȷ����
A����ҺA�е�������ΪFe2+��Fe3+��H+ B��V��224
C����Ʒ��CuO������Ϊ2.0g D����Ʒ��FeԪ�ص�����Ϊ1.07 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��c(H��)��c(OH��)��1��2��ˮ��Һ���ܴ���������������� ( )
A��K����Al3����HCO3����SO42�� B��Ca2����NH4����CO32����Cl��
C��Na����K����NO3����ClO�� D��Na����Fe2+��I����SO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ���ǣ�������
| �� | A�� | 1mol H2O������Ϊ18g/mol |
| �� | B�� | CH4��Ħ������Ϊ16g |
| �� | C�� | 3.01��1023��SO2���ӵ�����Ϊ32g |
| �� | D�� | ��״���£�1mol�κ����������Ϊ22.4L |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com