
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KClO3,且 的值与温度高低有关。当n(KOH) = a mol时,下列有关说法错误的是
A.参加反应的氯气的物质的量等于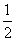 a mol
a mol
 B.若某温度下,反应后 =11,则溶液中 =
B.若某温度下,反应后 =11,则溶液中 = 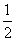
C. 改变温度,产物中KC1O3的最大理论产量为 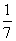 a mol
a mol
D.改变温度,反应中转移电子的物质的量ne的范围: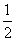 a mol ≤ ne ≤
a mol ≤ ne ≤ 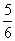 a mol
a mol
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
高炉炼铁过程中发生的主要反应为:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
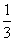 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
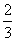 Fe(s)+CO2(g).
Fe(s)+CO2(g).
该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K= ,
ΔH 0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各
1.0 mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率
v(CO2)= ,CO的平衡转化率= ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是( )
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是( )
|
| A. | 此时水的离子积Kw=1×10﹣12 | B. | 水电离出的c(H+)=1×10﹣12mol/L |
|
| C. | 水的电离程度随温度升高而增大 | D. | c(Na+)=c(SO42﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.18gH2O含有10 NA个质子 B.1mol己烷含有18NA个化学键
C. 22.4L氨水含有NA个NH3分子 D.56g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O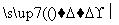 X+H2
X+H2
③Y+NaOH―→G+Q+H2O ④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )。
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是
,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚(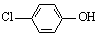 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。
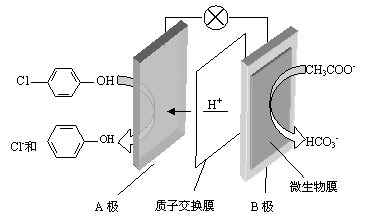
①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
|
 |  | ||||
 |
 |
① 阳极的电极反应式为 。
② 简述浓缩室中得到浓乳酸的原理: 。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g?L-1乳酸溶液通电一段时间后,浓度上升为145 g?L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g? mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用碱式滴定管量取0.1mol/L的NaOH溶液,开始时仰视液面,读数为11.00mL,取出部分溶液后,俯视液面,读数为19. 00mL,实际取出液体的体积是
A.大于8.00mL B.小于8.00mL C.等于8. 00mL D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
关于用CCl4萃取碘水的说法中不正确的是( )
A.碘在CCl4中的溶解度大于在水中的溶解度 B.萃取后上层颜色变浅
C.萃取后CCl4溶液层为紫红色 D.用酒精也可萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是( )
A.H+、Ba2+、Mg2+、N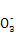 B.Cl-、C
B.Cl-、C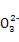 、Cu2+、Mg2+
、Cu2+、Mg2+
C.N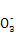 、S
、S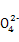 、K+、OH- D.N
、K+、OH- D.N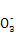 、HC
、HC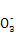 、Ba2+、Cl-
、Ba2+、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com