
��1���£�N2H4���Ƿ��亽��ɴ����õĸ���ȼ�ϣ���NH3��NaClO��һ�����ʵ����Ȼ�Ϸ�Ӧ�������¡�NaCl��ˮ���÷�Ӧ�Ļ�ѧ����ʽ�ǡ�2NH3+NaClO=N2H4+NaCl+H2O����
��2���ڻ���ƽ�����װ��ǿ��ԭ���£�N2H4����ǿ�������������⣬�����ǻ��ʱ���������������壬���ų������ȣ���֪��H2O��l�� H2O��g����H=+44kJ/mol��12.8gҺ̬���������������ⷴӦ���ɵ�����ˮ�������ų�256.65kJ��������
����д��Һ̬����������ⷴӦ����Һ̬ˮ���Ȼ�ѧ����ʽ������
����16g Һ̬���������������ⷴӦ����Һ̬ˮʱ�ų��������ǡ�����
| �Ȼ�ѧ����ʽ���йط�Ӧ�ȵļ��㣮. | |
| ר�⣺ | ��ѧ��Ӧ�е������仯�� |
| ������ | ��1��NH3��NaClO��Ӧ�����¡�NaCl��ˮ�����ݵ�ʧ�����غ��ԭ���غ�����ƽ����ʽ�� ��2�������ݸ�˹���ɼ���ķ�������Ȼ�ѧ����ʽ��д����д������ע���ʾۼ�״̬�ͷ�Ӧ�ʱ䣮 �������Ȼ�ѧ����ʽ��˹���ɼ���õ��Ȼ�ѧ����ʽ���õ���Ӧ���ʱ䣮 |
| ��� | �⣺��1�������������֪��NH3��NaClO��Ӧ�����¡�NaCl��ˮ�����ݵ�ʧ�����غ��ԭ���غ�����ƽ����ʽ��2NH3+NaClO=N2H4+NaCl+H2O�� �ʴ�Ϊ��2NH3+NaClO=N2H4+NaCl+H2O�� ��2���ٸ���12.8gҺ̬�¼�0.4mol���������������ⷴӦ���ɵ�����ˮ�������ų�256.65kJ����������д���Ȼ�ѧ����ʽ�� N2H4��l��+2H2O2��l��=N2��g��+4H2O��g����H=��641.625kJ/mol �� ��֪��H2O��l��=H2O��g����H=+44kJ/mol �� ���٩��ڡ�4����Һ̬����������ⷴӦ����Һ̬ˮ���Ȼ�ѧ����ʽ�� N2H4��l��+2H2O2��l��=N2��g��+4H2O��l����H=����641.625kJ/mol������+44kJ/mol����4=��817.625kJ/mol�� �ʴ�Ϊ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��l����H=��817.625kJ/mol�� �ڸ����Ȼ�ѧ����ʽ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��l�� H=��817.625kJ/mol��֪��1molN2H4��l����32g����ȫȼ�շ���817.625kJ����16g Һ̬���������������ⷴӦ����Һ̬ˮʱ�ų���������408.8125kJ�� �ʴ�Ϊ��408.8125kJ�� |
| ������ | ���⿼���˷�Ӧ����д����˹���ɵ�Ӧ�úͷ�Ӧ�ȵļ��㣬�ѶȲ���ע�����ʵ�״̬�IJ�ͬ�Է�Ӧ�ȵ�Ӱ�죮 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ܵ�ú������Ҫ�ɷ���H2��CO�������ļ��顣��Ӧ���Ȼ�ѧ��Ӧ����ʽΪ��
2H2(g)��O2(g)===2H2O(l)�� ��H����571.6 kJ/mol
2CO(g)��O2(g)===2CO2(g)�� ��H����566 kJ/mol
CH4(g)��2O2(g)===CO2(g)��2H2O(l)�� ��H����890.3 kJ/mol
��ʹ�ùܵ�ú�����û�������Ȼ��������ͬ������ȼ�յ��������Ȼ����
����������õ���ֵ��ǰ�ߴ�Լ�Ǻ��ߵĶ��ٱ�(����)
A��0.8 B��1.3 C��3.1 D��0.32
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йص�������ȷ���ǣ� ��
A��HClO�����ᣬ����NaClO���������
B�����ˮ����μ�����������FeCl3��Һ�����Ƶ�Fe(OH)3����
C�����ݷ�ɢ�����ӵ�ֱ����С����ɢϵ�ɷ�Ϊ��Һ����Һ�ͽ��壬��Һ�ķ�ɢ�����Ӵ�С������Һ�뽺��֮��
D����ѪҺ����ԭ���뽺���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijһԪ�л���HA����Һ�У���δ�����HA���Ӹ�������Һ�е����Ӹ�����Ϊa��b����HA�ĵ���ȣ���ת���ʣ��ǣ�������
| �� | A�� |
| B�� |
| C�� |
| D�� |
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
100��ʱ����pH=6������ˮ�м���NaHSO4���壬�����¶Ȳ��䣬�����Һ��pHΪ2��������������ȷ���ǣ�������
| �� | A�� | ��ʱˮ�����ӻ�Kw=1��10��12 | B�� | ˮ�������c��H+��=1��10��12mol/L |
| �� | C�� | ˮ�ĵ���̶����¶����߶����� | D�� | c��Na+��=c��SO42���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ܱ������У���1.0molCO��1.0molH2O��ϼ��ȵ�800�棬�������з�Ӧ��CO��g��+H2O��g��⇌CO2��g��+H2��g����һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
��1���ﵽƽ��ʱCO2�����ʵ��������÷�Ӧ�Ļ�ѧƽ�ⳣ����
��2���ﵽƽ������ƽ����ϵ��ͨ��1.0molˮ�������ﵽ�µ�ƽ��״̬ʱ����ˮ���������ʵ�����CO2�����ʵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ���������ֵ������˵����ȷ����
A.18gH2O����10 NA������ B.1mol���麬��18NA����ѧ��
C. 22.4L��ˮ����NA��NH3���� D.56g��ƬͶ������ŨH2SO4������NA��SO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Թ�ҵ��ˮ��������ˮ���д����Ƿ�ֹˮ����Ⱦ������ˮ�ʵ���Ҫ��ʩ��
��1�������ˮ�е�CN���о綾��
��CN����CԪ����+2�ۣ� NԪ����-3�ۣ���ԭ�ӽṹ����NԪ���Ը��۵�ԭ����
�����õ��Ӷ�ƫ��Nԭ�ӣ�NԪ���Ը��ۡ�
��������������£�CN���ܹ�������������HCO3-��ͬʱ����NH3���÷�Ӧ�����ӷ���ʽΪ ��
��2���������ƺͶ��ȷӣ�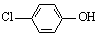 ���ķ�ˮ�������������س�ȥ����ԭ������ͼ��ʾ��
���ķ�ˮ�������������س�ȥ����ԭ������ͼ��ʾ��
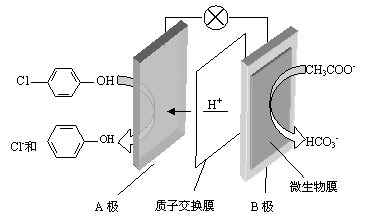
��B�ǵ�ص� �����������������
��A���ĵ缫��ӦʽΪ ��
|
 |  | ||||
 |
 |
�� �����ĵ缫��ӦʽΪ ��
�� ����Ũ�����еõ�Ũ�����ԭ���� ��
�� �������У���ȡһ���Ĵ�ʩ�ɿ��������ҵ�pHԼΪ6-8����ʱ����Ũ���ҵ�OH-�ɺ��Բ��ơ�400mL 10 g?L-1������Һͨ��һ��ʱ���Ũ������Ϊ145 g?L-1����Һ����仯���Բ��ƣ��������ϲ�����H2�ڱ�״���µ����ԼΪ L���������Ħ������Ϊ90 g? mol-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�˵����ȷ���� (����)
A����ӦNH3(g)+HCl(g)= NH4Cl(s)�������¿��Է����У���÷�Ӧ�ġ�H<0
B�����������Ͷ�п���Ʋ�����ʱ�����߸��ױ���ʴ
C��CH3COOH��Һ��ˮϡ�ͺ���ƽ�������ƶ�����Һ�е�c(CH3COO-)����
D��Na2CO3��Һ�м�������Ca(OH)2���壬CO32��ˮ��̶ȼ�С����Һ��pH��С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com