
在密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.求:
(1)达到平衡时CO2的物质的量分数和该反应的化学平衡常数;
(2)达到平衡后向该平衡体系中通入1.0mol水蒸气,达到新的平衡状态时,求水蒸气的物质的量和CO2的物质的量分数.
| 化学平衡的计算.. | |
| 专题: | 化学平衡专题. |
| 分析: | 令容器体积为1L,根据反应的方程式H2O (g)+CO (g) |
| 解答: | 解:(1)令容器体积为1L, H2O (g)+CO (g)⇌ 起始(mol•L ﹣1):1 1 0 0 变化(mol•L ﹣1):0.5 0.5 0.5 0.5 平衡(mol•L ﹣1):0.5 0.5 0.5 0.5 则平衡时CO2的物质的量分数= 该反应的化学平衡常数K= 答:达到平衡时CO2的物质的量分数为25%,该反应的化学平衡常数为1; (2)如果继续向该平衡体系中通入1.0mol的H2O(g),设从起始到平衡CO的浓度变化为xmol•L ﹣1, H2O (g)+CO(g) 起始(mol•L ﹣1):2 1 0 0 变化(mol•L ﹣1):x x x x 平衡(mol•L ﹣1):(2﹣x) (1﹣x) x x k= 所以平衡时水蒸气的物质的量为2﹣ 答:水蒸气的物质的量为1.33mol,CO2的物质的量分数为22.22%. |
| 点评: | 本题考查化学平衡的计算,题目难度中等,本题注意根据物质的量浓度的变化利用三段式法解答. |


科目:高中化学 来源: 题型:
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,
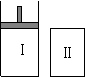 在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,
在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,
发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)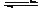 aZ(g)。
aZ(g)。
此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.a为2
D.平衡时Ⅰ容器的体积小于V L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质全部是弱电解质的是( )
A.H2SiO3 H2S CO2 B.MgSO4 CH3COOH CH3CH2OH
C.H2SO3 BaSO4 CH4 D.H2O NH3•H2O H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)⇌nY(g);△H=Q kJ/mol.反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
| /L积体气温体c(Y)/mol•L﹣1度/℃ | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是( )
|
| A. | m>n |
|
| B. | Q<0 |
|
| C. | 温度不变,压强增大,Y的质量分数减少 |
|
| D. | 体积不变,温度升高,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)肼(N2H4)是发射航天飞船常用的高能燃料.将NH3和NaClO按一定物质的量比混合反应,生成肼、NaCl和水,该反应的化学方程式是 2NH3+NaClO=N2H4+NaCl+H2O .
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量气体,并放出大量热.已知:H2O(l) H2O(g)△H=+44kJ/mol.12.8g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量.
①请写出液态肼与过氧化氢反应生成液态水的热化学方程式 .
②则16g 液态肼与足量过氧化氢反应生成液态水时放出的热量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、共价键 B.范德华力、范德华力、范德华力
C.范德华力、共价键、共价键 D.共价键、共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应
①Br2 + 2e- = 2Br- ②2Br- - 2e- = Br2 ③Zn – 2e- = Zn2+ ④Zn2+ + 2e- = Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
A.②和③ B.②和① C.③和① D.④和①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中各微粒的浓度关系不正确的是 ( )
A.0.1 mol/LCH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L
B.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
C.Na2S溶液中:2 c(Na+)= c(S2-) + c(HS-)+ c(H2S)
D.NaHCO3溶液中: c(OH-) = c(H+) + c(H2CO3)-c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com