
下列各组物质全部是弱电解质的是( )
A.H2SiO3 H2S CO2 B.MgSO4 CH3COOH CH3CH2OH
C.H2SO3 BaSO4 CH4 D.H2O NH3•H2O H3PO4
考点:
强电解质和弱电解质的概念..
专题:
电离平衡与溶液的pH专题.
分析:
强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物.一般包括强酸、强碱和大部分盐类;
弱电解质是指:在水溶液里部分电离的电解质,包括弱酸、弱碱、水与少数盐.据此即可解答.
解答:
解:A.H2SiO3 H2S 在水中能部分电离,属于弱电解质,二氧化碳本身在水中或者熔融状态下不能电离,属于非电解质,故A错误;
B.MgSO4 为盐,在水溶液中或熔融状态下,能够完全电离,为强电解质,CH3COOH在水溶液中能部分电离为弱电解质,CH3CH2OH在水中或者熔融状态下不能电离,属于非电解质,故B错误;
C.BaSO4 熔融状态下,能够完全电离,为强电解质,H2SO3水溶液中能部分电离为弱电解质,CH4在水中或者熔融状态下不能电离,属于非电解质,故C错误;
D.H2O NH3•H2O H3PO4 三种物质在水溶液中部分电离,都属于弱电解质,故D正确;
故选:D.
点评:
本题主要考查了强、弱电解质的判断,抓住弱电解质的特征“不能完全电离”,注意积累常见的弱电解质有助于解题.


科目:高中化学 来源: 题型:
下列方法中可以说明2HI(g)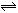 H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
A、②③⑤ B、①④⑦ C、②⑦⑨ D、⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
恒容密闭容器中,发生反应H2(g)+Br2(g) 
 2HBr(g) ΔH<0。恒温下
2HBr(g) ΔH<0。恒温下
发生反应,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述
反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A.a>b B.a=b C.a<b D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L
B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C.0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为 2×6.02×1023
D.10g 98%硫酸(密度为1.84g/cm3)与10 mL 18.4 mol/L硫酸的浓度是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关的叙述正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
D.“血液透析”原理与胶体的性质无关
查看答案和解析>>
科目:高中化学 来源: 题型:
某一元有机酸HA的溶液中,若未电离的HA分子个数与溶液中的离子个数比为a:b,则HA的电离度(即转化率)是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.求:
(1)达到平衡时CO2的物质的量分数和该反应的化学平衡常数;
(2)达到平衡后向该平衡体系中通入1.0mol水蒸气,达到新的平衡状态时,求水蒸气的物质的量和CO2的物质的量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是( )
A.CaO+H2O==Ca(OH)2 B.Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
C.CaCO3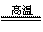 CaO+CO2↑ D.CO2+2NaOH==Na2CO3+H2O
CaO+CO2↑ D.CO2+2NaOH==Na2CO3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com