
可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应
①Br2 + 2e- = 2Br- ②2Br- - 2e- = Br2 ③Zn – 2e- = Zn2+ ④Zn2+ + 2e- = Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
A.②和③ B.②和① C.③和① D.④和①
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L
B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C.0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为 2×6.02×1023
D.10g 98%硫酸(密度为1.84g/cm3)与10 mL 18.4 mol/L硫酸的浓度是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.求:
(1)达到平衡时CO2的物质的量分数和该反应的化学平衡常数;
(2)达到平衡后向该平衡体系中通入1.0mol水蒸气,达到新的平衡状态时,求水蒸气的物质的量和CO2的物质的量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为
ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A.ρ=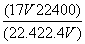 B.w=
B.w=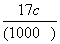 C.w=
C.w=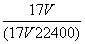 D.c=
D.c=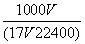
查看答案和解析>>
科目:高中化学 来源: 题型:
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是
,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚(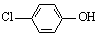 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。
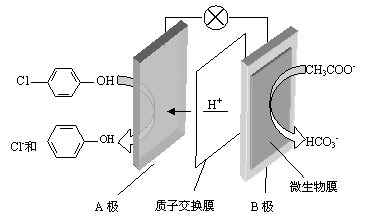
①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
|
 |  | ||||
 |
 |
① 阳极的电极反应式为 。
② 简述浓缩室中得到浓乳酸的原理: 。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g?L-1乳酸溶液通电一段时间后,浓度上升为145 g?L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g? mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应,生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示(图中△H表示生成1 mol 产物的数据)。
根据图回答下列问题:
 (1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式:
(2)PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式:
____________________;
(3)上述分解反应是一个可逆反应。温度T1时,在体积为1L的密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于 ,平衡常数K1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,平衡常数为K2,则α2 α1,
K2 K1。(填“大于”、“小于”或“等于”)
(4)P和Cl2分两步反应生成1mol PCl5的△H3 =
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是( )
A.CaO+H2O==Ca(OH)2 B.Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
C.CaCO3 CaO+CO2↑ D.CO2+2NaOH==Na2CO3+H2O
CaO+CO2↑ D.CO2+2NaOH==Na2CO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
有一包白色固体粉末,可能含有CuSO4、Ba(NO3)2、Na2SO4、K2CO3、KCl中的一种或几种,按以下步骤进行实验:
①将该固体粉末溶于足量水中得无色溶液和白色沉淀 ②加入足量稀硝酸,沉淀部分溶解并有气体产生
根据以上实验现象推断:
(1)该白色粉末中一定含有 ;一定不含有 ;可能含有 (写化学式)
(2)生成白色沉淀的离子方程式为: 、
(3)沉淀加入稀硝酸反应的离子方程式为:
(4)要确定可能含有的物质,还需要进行的实验操作是
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
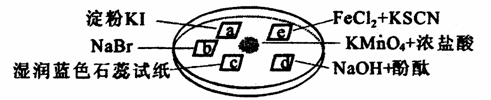
对实验现象的“解释或结论”正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2> |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色7 | 氯气与水生成了漂白性物质 |
| | e处变红色 | 还原性:Fe2+>Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com