
【题目】在常温下,0.100 0 mol·L-1Na2CO3溶液25 mL用0.1000 mol·L-1盐酸滴定,滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是
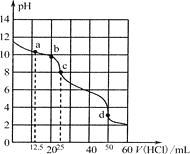
A. a点:c(CO32-)>c(HCO3-)>c(OH-)
B. b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C. c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
【答案】BD
【解析】试题分析:A、a点对应盐酸的体积比12.5mL多,0.100 0 mol·L-1Na2CO3溶液25 mL用0.1000 mol·L-1盐酸滴定,若消耗12.5mL的盐酸,则有一半的碳酸钠转化为碳酸氢钠,所以a点时溶液中碳酸氢钠的物质的量大于碳酸钠的物质的量,则离子浓度的关系是c(HCO3-)>c(CO32-)>c(OH-),错误;B、b点时加入盐酸的体积是20mL,此时n(Cl-)=0.002mol,而c(CO32-)+c(HCO3-)+ c(H2CO3)=0.025mol,则5c(Cl-)=4c(HCO3-)+4c(CO32-)+4 c(H2CO3),所以5c(Cl-)>4c(HCO3-)+4c(CO32-),正确;C、c点时,加入盐酸的体积为25mL,则碳酸钠恰好全部转化为碳酸氢钠,该溶液为碳酸氢钠溶液,溶液中的c(HCO3-)> c(OH-),错误;D、d点时,加入盐酸的体积是50mL,则碳酸钠完全与盐酸反应生成二氧化碳,得到的溶液为氯化钠溶液,因为溶液中溶有二氧化碳,所以溶液呈酸性,根据电荷守恒,则c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+ c(Cl-),因为此时钠离子与氯离子的浓度相等,所以c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),正确,答案选BD。


科目:高中化学 来源: 题型:
【题目】有机物G是一种常用的植物调味油,可按如下路线合成:

已知:![]()
回答下列问题:
(1)下列关于乙烯的说法不正确的是_________(填字母)。
a.分子中所有原子共平面
b.能发生氧化反应,不能发生还原反应
c.能发生加聚反应生成高分子
d.能使酸性高锰酸钾溶液褪色
(2)由F生成G的反应类型为_________________________。
(3)C中官能团的名称为___________,由C生成D的反应类型为___________。
(4)D的化学名称为___________,由D生成E的化学方程式为___________。
(5)苯环上含有两个取代基,且分子中含有酯基的F的同分异构体有_________种,其中核磁共振氢谱显示有四组峰,且峰面积之比为3:2:2:3的是__________(填结构简式)。
(6)参照上述合成路线,设计以B为原料(无极试剂任选)制备高吸水性树脂![]() 的合成路线:________________。
的合成路线:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列保存物质方法正确的是
A. 氢氟酸保存在用塑料盖的玻璃瓶中B. 氯水应保存在棕色的细口瓶中
C. NaOH固体可长期保存在玻璃瓶中D. 金属钠应存放在四氯化碳中防止被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下面的实验过程完成下题:

(1)写出上述过程颜色变化(a)________;(b)______;(d)________。
(2)写出上述反应的化学方程式:(1)____________;(3)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量变化的说法正确的是( )
A. 化学反应通常伴随着能量变化,其表现形式只有吸热和放热两种
B. 需要在高温条件下才能发生的反应一定是吸热反应
C. 因为3O2![]() 2O3是吸热反应,所以O3比O2更稳定
2O3是吸热反应,所以O3比O2更稳定
D. 吸收或放出热量的多少与参加反应的物质的多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验,并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A中的位置,在实验开始时,为控制并测量反应溶液的温度,温度计水银球的位置应在_____________;当试管A中的主要反应完成后,为在C中收集乙酸,温度计水银球的位置应在______________,该操作名称为 _____________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
(3)乙酸是非常重要的工业原料,其氯代物——氯乙酸可在工业上生产食品香精菠萝酯( ),实验室模拟工业简易流程如下:
),实验室模拟工业简易流程如下:

反应室I中发生反应的反应类型是___________。
分离室II的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;
洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是__________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 31g白磷(![]() )分子中含有1 NA 个P-P键
)分子中含有1 NA 个P-P键
B. 1molFeI2与1molCl2反应时转移的电子数为3NA
C. 标准状况下,4.48LCH4和乙烯(CH2=CH2)的混合气体完全燃烧,产生的水中所含O-H键数目为0.8NA
D. 常温下,将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间有下图所示的转化关系.已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体.
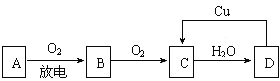
请回答下列问题:
(1)写出A和C的名称或化学式:A_________________,C________________;
(2)在上图D→C的过程中,D表现出强__________________(填“氧化性”或“还原性”);
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是_________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com