
【题目】新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃、101kPa时:
①C(s)+![]() O2(g)=CO(g) ΔH=-126.4kJ/mol
O2(g)=CO(g) ΔH=-126.4kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
则在25℃、101kPa时:
C(s)+H2O(g)=CO(g)+H2(g) ΔH=_____。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值____(填“增大”“减小”或“不变”)。
②1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应是否处于化学平衡状态?____(填“是”或“否”),其判断依据是___。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。
现向体积为1L的恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=____。
②下列措施能使![]() 增大的是____(填字母)。
增大的是____(填字母)。
A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
【答案】+115.4 kJ/mol 增大 否 浓度商Q小于平衡常数K 0.225mol/(L·min) BD
【解析】
(1)①C(s)+![]() O2(g)=CO(g) ΔH=-126.4kJ/mol
O2(g)=CO(g) ΔH=-126.4kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
将①+③-![]() ×②得:
×②得:
C(s)+H2O(g)=CO(g)+H2(g) ΔH=+115.4 kJ/mol
答案为:+115.4 kJ/mol
(2)①因为正反应为吸热反应,所以温度升高,化学平衡正向移动,移动后达到新的平衡,此时平衡常数K值增大。答案为:增大
②1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应没有处于化学平衡状态。答案为:否
其判断依据是Q=![]() ,平衡正向移动。
,平衡正向移动。
答案为:浓度商Q小于平衡常数K
(3) CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量 1.00 3.00 0 0
变化量 0.75 2.25 0.75 0.75
平衡量 0.25 0.75 0.75 0.75
①从反应开始到平衡,氢气的平均反应速率v(H2)=![]() mol/(L·min)
mol/(L·min)
答案为:0.225mol/(L·min)
②A.升高温度,平衡逆向移动,c(CH3OH)减小,c(CO2)增大,![]() 减小,不合题意;
减小,不合题意;
B.再充入H2,平衡正向移动,c(CH3OH)增大,c(CO2) 减小,![]() 增大,符合题意;
增大,符合题意;
C.再充入CO2,虽然平衡正向移动,c(CH3OH)增大,c(CO2)增大,但c(CO2)增大的更多,![]() 减小,不合题意;
减小,不合题意;
D.将H2O(g)从体系中分离,平衡正向移动,c(CH3OH)增大,c(CO2) 减小,![]() 增大,符合题意;
增大,符合题意;
E.充入He(g),使体系压强增大,c(CH3OH)不变,c(CO2)不变,![]() 不变,不合题意。
不变,不合题意。
故选BD。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)![]() x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
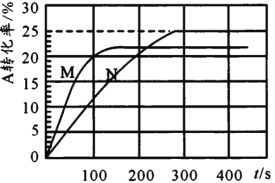
A.x可能为4
B.M为容器甲
C.容器乙达平衡时B的转化率为25%
D.M的平衡常数大于N
查看答案和解析>>
科目:高中化学 来源: 题型:
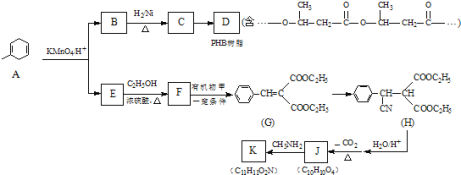
【题目】PHB是一种树脂,有机物K是一种抗惊厥药物,它们的合成路线如下:
已知:R、R′、R″代表烃基
①RCN→H2O/H+RCOOH
②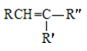
![]() RCOOH+
RCOOH+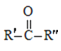
③
![]()
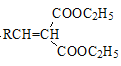 +H2O
+H2O
(1)B→C的反应类型是_____.
(2)写出一定条件下C→D的化学方程式_____:.
(3)有机物甲的结构简式为_____.
(4)写出E→F的化学方程式_____.
(5)已知1mol J最多与2mol NaHCO3反应;K分子结构中含有一个五元环与一个六元环.写出一定条件下J→K的化学方程式:_____.
(6)S是A的一种同分异构体,分子中没有环状结构,S的核磁共振氢谱有三个峰,峰面积之比为6:3:1,则S的结构简式为(写出一种即可)_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下0.1 mol/L的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列关系一定正确的是( )
A. c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B. c(Na+)=0.1 mol/L≥c(B2-)
C. HB-的水解方程式为HB-+H2O![]() B2-+H3O+
B2-+H3O+
D. 在该盐的溶液中,离子浓度大小顺序为c(Na+)>c(HB-)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O.下列说法错误的是( )
MnCl2+Cl2↑+2H2O.下列说法错误的是( )
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 molCl2,转移电子的物质的量为2 mol
C. 每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D. 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质是LiClO4,溶于混合有机溶剂中,金属锂离子(Li+)通过电解质迁移入二氧化锰晶格中,生成LiMnO2。
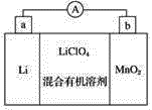
回答下列问题:
(1)外电路的电流方向是由________极流向________极(填字母)。
(2)电池的正极反应式为___________。
(3)是否可用水代替电池中的混合有机溶剂________(填“是”或“否”),原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应Ⅰ:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ/mol
HCHO(g)+H2(g) △H1=+85.2kJ/mol
反应Ⅱ:CH3OH(g)+12O2(g)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应Ⅲ:2H2(g)+O2(g)![]() 2H2O(g) △H3=483.6kJ/mol
2H2O(g) △H3=483.6kJ/mol
(1)计算反应Ⅱ的反应热△H2=___。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)=sHCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为a,则平衡时的总压强P平=___(用含P0和a的式子表示):当P0=101kPa,测得a=50.0%,计算反应平衡常数Kp=___kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com