
ЁОЬтФПЁПЧыИљОнвЊЧѓЬюПеЃК
ЃЈ1ЃЉЫЎЕФЕчРыгыШмвКЕФЫсМюадУмЧаЯрЙиЁЃ
ЂйГЃЮТЯТЃЌФГФћУЪЫЎШмвКЕФpH=3ЃЌЦфжаЕФc(OH-)=__________ЁЃ
ЂкГЃЮТЯТ,ХЈЖШОљЮЊ0.1 molL-1ЕФCH3COOHШмвККЭCH3COONaШмвКжа,ЫЎЕФЕчРыГЬЖШДѓаЁЙиЯЕЪЧЃКЧАеп_____________КѓепЃЈЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБЃЉЃЛ
ЂлГЃЮТЯТЃЌХЈЖШОљЮЊ0.1 molL-1ЕФNaXКЭNaYСНжжбЮШмвКЃЌЦфpHЗжБ№ЮЊ8 КЭ10ЃЌдђHX КЭHYЕФЫсадЧПШѕЙиЯЕЪЧЃКHX_________HY(ЬюЁА>ЁБЛђЁА<ЁБ)ЁЃ
ЃЈ2ЃЉбаОПЛЏбЇФмгыЕчФмЯрЛЅзЊЛЏЕФзАжУЁЂЙ§ГЬКЭаЇТЪЕФПЦбЇЃЌНазіЕчЛЏбЇЁЃ
ЂйФГдЕчГизАжУШчгвЭМЃЌдђЃК

ИУдЕчГиЕФИКМЋЪЧ__________ЃЈЬюЁАZnЁБЛђЁАCuЁБЃЉЃЌе§МЋЕФЕчМЋЗДгІЪНЮЊ_______________________ЃЛ
ЂкгУВЌЕчМЋЕчНтФГН№ЪєТШЛЏЮя(XCl2)ЕФШмвКЃЌЕБЪеМЏЕН2.24 LCl2ЃЈБъзМзДПіЃЉЪБЃЌвѕМЋдіжи6.4 gЃЌдђИУН№ЪєЕФЯрЖддзгжЪСПЮЊ_______________________________ЁЃ
ЁОД№АИЁП 1.0ЁС10-11 < > Zn Cu2++2e-==Cu 64
ЁОНтЮіЁПЃЈ1ЃЉЂйГЃЮТЯТЃЌФГФћУЪЫЎШмвКЕФpH=3,дђЦфжаЕФc(H +)=1.0ЁС10-3mol/LЃЌгЩЫЎЕФРызгЛ§ГЃЪ§ПЩвдЧѓГіc(OH -)=1.0ЁС10-11mol/L;
ЂкCH3COOHЕчРыЕФЧтРызгПЩвдвжжЦЫЎЕФЕчРыЃЌCH3COONaЫЎНтПЩвдДйНјЫЎЕФЕчРыЁЃГЃЮТЯТЃЌХЈЖШОљЮЊ0.1mol/LЕФCH3COOHШмвККЭCH3COONaШмвКжаЃЌЫЎЕФЕчРыГЬЖШДѓаЁЙиЯЕЪЧЃКЧАеп<КѓепЃЛ
ЂлГЃЮТЯТЃЌХЈЖШОљЮЊ0.1mol/LЕФNaXКЭNaY СНжжбЮШмвКЃЌЦфpH ЗжБ№ЮЊ8КЭ10ЃЌЫЕУїY-ЫЎНтГЬЖШНЯДѓЃЌдђHXКЭHYЕФЫсадЧПШѕЙиЯЕЪЧHX>HYЃЛ
ЃЈ2ЃЉЂйгЩЭМПЩжЊЃЌИУдЕчГиЕФИКМЋЪЧZnЃЌе§МЋЕФЕчМЋЗДгІЪНЮЊCu2++2e- =Cu.
ЂкгУВЌЕчМЋЕчНтФГН№ЪєТШЛЏЮя(XCl2)ЕФШмвКЃЌЕБЪеМЏЕН2.21LCl2(БъзМзДПі)ЪБЃЌЕчТЗжазЊвЦЕчзгЕФЮяжЪЕФСПЮЊ0.2molЃЌвѕМЋдіжи6.4gЃЌгЩвѕМЋЕФЕчМЋЗДгІX2++2e- =XПЩжЊЃЌвѕМЋЩњГЩ0.1mol X ЃЌИУН№ЪєЕФЯрЖддзгжЪСПЮЊ![]() 64ЁЃ
64ЁЃ


 МЦЫуИпЪжЯЕСаД№АИ
МЦЫуИпЪжЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТСЭСПѓЕФжївЊГЩЗжЪЧAl2O3ЃЌДЫЭтЛЙКЌгаЩйСПSiO2ЁЂFe2O3ЕШдгжЪЃЌЯТЭМЫљЪОЪЧДгТСЭСПѓжажЦБИТСЕФЙЄвеСїГЬ:

вбжЊ:ШмвКжаЙшЫсФЦгыЦЋТСЫсФЦЗДгІФмЩњГЩЙшТСЫсбЮГСЕэЃЌЛЏбЇЗНГЬЪНЮЊ:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8Ё§+4NaOHЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. ТЫдќAЕФГЩЗжЮЊNa2Al2Si2O8КЭFe2O3
B. гУЙ§СПCO2ЫсЛЏЃЌЩњГЩAl(OH)3ЕФЗДгІ:AlO2-+CO2+2H2O=Al(OH)3Ё§+HCO3-
C. Й§ТЫВйзїЪБЃЌгУВЃСЇАєНСАшЃЌПЩвдМгПьЙ§ТЫЫйЖШ
D. зЦЩеВйзїЧАЃЌлсліашЯШЯДОЛЃЌдйВСИЩ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаПТСКЯН№ЪЧвдZnЁЂAl ЮЊжїЃЌCuЁЂMgЮЊИЈЕФЖрдЊЛЏКЯН№ЁЃВтЖЈЦфжаCuКЌСПЕФЪЕбщВНжшШчЯТ:
ЂйГЦШЁИУКЯН№бљЦЗ1.100 gЃЌгУЯЁH2SO4КЭH2O2ШмНтКѓжѓЗаГ§ШЅЙ§СПH2O2ЃЌВавКЖЈШнгк250mLШнСПЦПжа;
ЂкгУвЦвКЙмвЦШЁ50.00mLХфжЦвКгк250mLЕтСПЦПжаЃЌЕїНкШмвКЕФpH=3~4ЃЌМгШыЙ§СПKIШмвК2Cu2++4I-=2CuIЁ§+I2)КЭ3-4ЕЮЕэЗлШмвК;
ЂлгУ1.100x10-2mol/LNa2S2O3ШмвКЕЮЖЈЩњГЩЕФI2жСжеЕу(I2+2S2O32-=2I-+S4O62-)ЃЌЯћКФNa2S2O3ШмвК6.45mLЁЃ
ЧыЛиД№:
(1)ВНжшЂйжаШмНтCuЕФРызгЗНГЬЪН___________________ЁЃ
(2)ВНжшЂлжаХаЖЯЕЮЖЈжеЕуЕФЗНЗЈ_______________________ЁЃ
(3)КЯН№жаCuЕФжЪСПЗжЪ§_____________ЁЃ(НсЙћБЃСєШ§ЮЛгааЇЪ§зж)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГПЦбаШЫдБЩшМЦГіНЋСђЫсдќЃЈжївЊГЩЗжFe2O3ЃЌКЌгаЩйСПЕФSiO2ЕШдгжЪЃЉдйРћгУЕФСїГЬЃЈШчЯТЭМЃЉЃЌСїГЬжаЕФТЫвКОЙ§ЖрДЮбЛЗКѓгУРДКѓајжЦБИбѕЛЏЬњЗлФЉЁЃ

ЃЈ1ЃЉЮЊСЫМгПьЗДгІЂйЕФЗДгІЫйТЪЃЌГ§СЫНСАшЁЂЪЪЕБЩ§ИпЮТЖШЁЂНЋСђЫсдќЗлЫщЭтЛЙПЩВЩгУЕФДыЪЉЪЧ____________________________ЃЈаДГівЛЕуМДПЩЃЉЁЃ
ЃЈ2ЃЉЗДгІЂкжївЊзїгУЪЧЁАЛЙдЁБЃЌМДНЋFe3+зЊЛЏЮЊFe2+ЁЃдкЮТЖШT1ЁЂT2ЃЈT1ЃОT2ЃЉЯТНјааИУЗДгІЃЌЭЈЙ§МьВтЯрЭЌЪБМфФкШмвКЕФpHЃЌЛцжЦpHЫцЪБМфЕФБфЛЏЧњЯпШчЯТЭМЫљЪОЃЎЕУГіНсТлЃКИУЗДгІЕФЮТЖШВЛвЫЙ§ИпЁЃ

ЂйвбжЊаХЯЂЃКpH= -lgc(H+)ЃЌШч0.1mol/LЕФбЮЫсЕФpH= -lg0.1=1ЁЃдкЩЯЪіСїГЬжаЭЈШыSO2ЦјЬхЁАЛЙдЁБЪБЃЌЪдгУРызгЗНГЬЪНКЭЪЪЕБЮФзжРДНтЪЭpHЯТНЕЕФдвђЪЧ__________________________ЃЛ
ЂкЯрЭЌЪБМфФкЃЌT1ЮТЖШЯТЃЌШмвКЕФpHИќИпЕФдвђЪЧ____________________________________ЁЃ
ЃЈ3ЃЉИУСїГЬжабЛЗЪЙгУЕФЮяжЪЪЧ _____________ЁЃ
ЃЈ4ЃЉЯжгавЛАќЙЬЬхFeOКЭFe2O3ЃЌгћвЊЛЏбЇЗНЗЈШЗЖЈЦфжаКЌгабѕЛЏбЧЬњЃЌгІбЁдёЕФЪдМСЪЧ________ЁЃЃЈЬюбЁКХзжФИЃЉ
A. бЮЫсЁЂСђЧшЛЏМиШмвК B. ЯЁСђЫсЁЂЫсадИпУЬЫсМиШмвК
C. ЯЁСђЫсЁЂСђЧшЛЏМиШмвК D. ЯЁЯѕЫсЁЂСђЧшЛЏМиШмвК
ЃЈ5ЃЉЮЊВтЖЈЗДгІЂйКѓШмвКжаFe3ЃЋЕФХЈЖШвдПижЦМгШыSO2ЕФСПЁЃЪЕбщВНжшЮЊЃКзМШЗСПШЁ20.00mlЕФЗДгІКѓШмвКЃЌЯЁЪЭГЩ100mLШмвКЃЌШЁ10.00 mLШмвКЃЌМгШызуСПЕФKIОЇЬхКЭ2ЁЋ3ЕЮЕэЗлШмвКЃЌгУ0.50mol/LЕФNa2S2O3ШмвКгыЕтЗДгІЃЌЕБЗДгІЧЁКУЭъШЋНјааЪБЃЌЙВЯћКФNa2S2O3ШмвК20.00 mLЁЃвбжЊЃК2Na2S2O3 + I2 ЃН Na2S4O6 + 2NaIЃЌЪдМЦЫудШмвКжаFe3ЃЋЕФЮяжЪЕФСПХЈЖШ(аДГіМЦЫуЙ§ГЬ)ЁЃ______________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯѕЫсЪЧвЛжжЧПбѕЛЏадЁЂИЏЪДадЕФЧПЫсЃЌЦфЛЙдВњЮявђЯѕЫсХЈЖШЕФВЛЭЌЖјгаБфЛЏЃЌДгзмЬхЩЯЫЕЃЌЯѕЫсХЈЖШдНИпЃЌЦНОљУПЗжзгЯѕЫсЕУЕНЕФЕчзгЪ§дНЩйЃЌХЈЯѕЫсЕФЛЙдВњЮяжївЊЮЊNO2ЃЌЯЁЯѕЫсЕФЛЙдВњЮяжївЊЮЊNOЁЃЪЕбщЪвжаЃЌГЃгУCuгыХЈHNO3ЗДгІжЦШЁNO2ЃЌгУCuгыЯЁHNO3ЗДгІжЦШЁNOЁЃ
ЃЈ1ЃЉЧыаДГіЪЕбщЪвжагУCuгыХЈHNO3ЗДгІжЦШЁNO2ЕФЛЏбЇЗНГЬЪНЃК_____________ЁЃ
ЃЈ2ЃЉИУЗДгІжаЗЂЩњбѕЛЏЗДгІЕФЮяжЪЪЧ__________ЃЌ1 molбѕЛЏМС_________(ЬюЁАЕУЕНЁБЛђЁАЪЇШЅЁБ)_______ molЕчзгЁЃ
ЃЈ3ЃЉ48.0 g CuгыЪЪСПЕФХЈHNO3ЗДгІЃЌЭШЋВПзїгУКѓЃЌЙВЪеМЏЕН22.4 LЦјЬх(БъзМзДПіЯТ)ЃЌЗДгІжаЯћКФHNO3ЕФЮяжЪЕФСППЩФмЪЧЃЈ ЃЉ
AЃЎ1.5 mol BЃЎ2.0 mol CЃЎ2.5 mol DЃЎ3.0 mol
ЃЈ4ЃЉЪЕМЪЩЯЯѕЫсВЛНіПЩБЛЛЙдЮЊNO2ЛђNOЃЌХЈЖШИќЯЁЪБЯѕЫсЛЙПЩвдБЛЛЙдЮЊN2OЁЂN2ЁЂNH4NO3ЕШЁЃЧыНЋ3жжЮяжЪЃК FeSO4ЁЂFe(NO3)3КЭFe2(SO4)3ЗжБ№ЬюШыЯТУцЖдгІЕФКсЯпЩЯЃЌзщГЩвЛИіЮДХфЦНЕФЛЏбЇЗНГЬЪНЁЃ
HNO3 ЃЋ ______ ![]() ______ ЃЋ ______ ЃЋ N2OЁќ ЃЋ H2O
______ ЃЋ ______ ЃЋ N2OЁќ ЃЋ H2O
ВЂаДГіХфЦНКѓЕФРызгЗНГЬЪНЃК_________________________ЁЃ
ЃЈ5ЃЉЯѕЫсЕФЛЙдВњЮяNOЁЂNO2ЁЂN2OЕШЖдЛЗОГОљгаИБзїгУЃЌЮЊСЫПЩГжајЗЂеЙЃЌЕБНёЩчЛсЬсГіЕФвЛИіаТИХФюЁЊЁЊЁАТЬЩЋЛЏбЇЁБЃЌЫќвЊЧѓДгОМУЁЂЛЗБЃКЭММЪѕЩЯЩшМЦПЩааЕФЛЏбЇЗДгІЃЌдђЯТСагЩЕЅжЪЭжЦШЁЯѕЫсЭЕФЗНЗЈПЩааЧвЗћКЯЁАТЬЩЋЛЏбЇЁБЕФЪЧЃЈ ЃЉ
AЃЎCu ![]() Cu(NO3)2
Cu(NO3)2
BЃЎCu ![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
CЃЎCu ![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2 ![]() Cu(NO3)2
Cu(NO3)2
DЃЎCu![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧІаюЕчГиЪЧЕфаЭЕФПЩГфаЭЕчГиЃЌЕчГизмЗДгІЪНЮЊЃКPb+PbO2+2H2SO4![]() 2PbSO4+2H2OЁЃ
2PbSO4+2H2OЁЃ

ЃЈ1ЃЉЗХЕчЪБЃЌе§МЋЕФЕчМЋЗДгІЪНЪЧ___________________________ЃЌЕчНтвКжаH2SO4ЕФХЈЖШж№НЅ________________ЃЌЕБЭтЕчТЗЭЈЙ§1molЕчзгЪБЃЌРэТлЩЯИКМЋАхЕФжЪСПдіМг________________gЁЃ
ЃЈ2ЃЉдкЭъШЋЗХЕчКФОЁPbO2КЭPbЪБЃЌШєАДЭМСЌНгЕчНтЃЌдђдкAЕчМЋЕФЕчМЋЗДгІЪНЪЧ___________________ЃЌ BЕчМЋЕФЕчМЋЗДгІЪНЪЧ____________________ЃЌЕчНтКѓЧІаюЕчГиЕФе§ЁЂИКМЋЕФМЋадНЋ______________ ЃЈЬюЁАИФБфЁБЛђЁАВЛИФБфЁБЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЕчНтжЪШмвКЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. Яђ0.1 molL-1CH3COOHШмвКжаМгШыЩйСПЫЎЃЌШмвКжа МѕаЁ
МѕаЁ
B. НЋCH3COONaШмвКДг20ЁцЩ§ЮТжС30ЁцЃЌШмвКжа  діДѓ
діДѓ
C. ЯђбЮЫсжаМгШыАБЫЎжСжаадЃЌШмвКжа >1
>1
D. ЯђAgClЁЂAgBrЕФБЅКЭШмвКжаМгШыЩйСПAgNO3ШмвКжа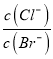 ВЛБф
ВЛБф
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкШнЛ§ВЛБфЕФУмБеШнЦїжаДцдкЗДгІЃК2SO2(g)+O2(g)![]() 2SO3(g)ІЄH<0ЃЌФГбаОПаЁзщбаОПСЫЦфЫћЬѕМўВЛБфЪБЃЌИФБфФГвЛЬѕМўЖдЩЯЪіЗДгІЕФгАЯьЃЌЯТСаЗжЮіе§ШЗЕФЪЧ( )
2SO3(g)ІЄH<0ЃЌФГбаОПаЁзщбаОПСЫЦфЫћЬѕМўВЛБфЪБЃЌИФБфФГвЛЬѕМўЖдЩЯЪіЗДгІЕФгАЯьЃЌЯТСаЗжЮіе§ШЗЕФЪЧ( )

A. ЭМЂёбаОПЕФЪЧt0ЪБПЬдіДѓO2ЕФХЈЖШЖдЗДгІЫйТЪЕФгАЯь
B. ЭМЂђбаОПЕФЪЧt0ЪБПЬМгШыДпЛЏМСЖдЗДгІЫйТЪЕФгАЯь
C. ЭМЂѓбаОПЕФЪЧДпЛЏМСЖдЦНКтЕФгАЯьЃЌЧвМзЕФДпЛЏаЇТЪБШввИп
D. ЭМЂѓбаОПЕФЪЧЮТЖШЖдЛЏбЇЦНКтЕФгАЯьЃЌЧвввЕФЮТЖШНЯЕЭ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЙиШШЛЏбЇЗНГЬЪНЪщаДгыЖдгІБэЪіОље§ШЗЕФЪЧ
A. ЯЁСђЫсгы0.1 molЃЏL NaOHШмвКЗДгІЃКH+(aq)+OHЃ(aq)= H2O(l) ЁїH = +57.3 kJЁЄmol1
B. вбжЊ2C(s)+O2(g)=2CO(g) ЁїH=ЁЊ221 kJЁЄmol-1ЃЌ дђПЩжЊCЕФШМЩеШШЮЊ110.5 kJЁЄmol1
C. УмБеШнЦїжаЃЌ0.3molСђЗлгы0.2molЬњЗлЛьКЯМгШШЩњГЩСђЛЏбЧЬњ0.2molЪБЃЌЗХГі19.12 kJШШСПЁЃдђFe(s)+S(s)=FeS(s) ЁїH= - 95.6 kJЁЄmol1
D. 500ЁцЁЂ30MPaЯТЃЌНЋ0.5mol N2КЭ1.5molH2жУгкУмБеЕФШнЦїжаГфЗжЗДгІЩњГЩNH3(g)ЃЌЗХШШ19.3kJЃЌЦфШШЛЏбЇЗНГЬЪНЮЊЃКN2(g) + 3H2(g) ![]() 2NH3(g) ЁїH= ЁЊ38.6kJЁЄmol1
2NH3(g) ЁїH= ЁЊ38.6kJЁЄmol1
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com