
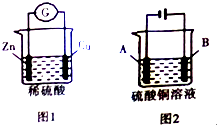
| A. | 图1装置将化学能转化为电能,电子由锌极经过稀硫酸进入铜极 | |
| B. | 利用图2装置可进行粗铜的精炼,则粗铜做A极 | |
| C. | 若A、B两电极均为铜,利用图2装置电解硫酸铜溶液,则电解后溶液的pH不变 | |
| D. | 利用图2装置可在铁上镀铜,则铁作B极 |
分析 A.原电池中化学能转化为电能,电子从负极流向正极;
B.电解精炼时,粗铜作阳极;
C.电解时,阴极铜离子得电子生成Cu,阳极Cu失电子生成铜离子;
D.电镀时,待镀金属作阴极.
解答 解:A.图1装置为原电池,原电池中化学能转化为电能,电子从负极流向正极,即电子由锌极经过外电路进入铜极,电子不通过溶液,故A错误;
B.电解精炼时,粗铜作阳极,则B极为粗铜,故B错误;
C.电解时,阴极铜离子得电子生成Cu,阳极Cu失电子生成铜离子,所以溶液中硫酸铜的浓度不变,则电解后溶液的pH不变,故C正确;
D.利用图2装置可在铁上镀铜,待镀金属铁作阴极,及铁为A极,故D错误.
故选C.
点评 本题考查了原电池原理和电解池原理,侧重于学生的分析能力的考查,能正确判断电池的类型及两极的反应是解本题的关键,题目难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:解答题
| 色态 | 溶于碱 | 常温常压 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 不稳定 | 爆炸 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6 NA个 | |
| C. | 25℃时,1L0.1mol•L-1FeCl3溶液中含有0.1 NA 个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题:
已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题: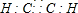 、
、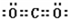 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 | |
| B. | 常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大 | |
| C. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,c(OH-)、CH3COOH的电离程度均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3水解:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用石墨作电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 乙醛与新制的Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com