
| 色态 | 溶于碱 | 常温常压 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 不稳定 | 爆炸 |

分析 (1)二氧化氯的熔点较低、易挥发,遇光易爆炸;
(2)①KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,反应方程式为2KClO3+H2C2O4+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+2CO2↑+2KHSO4+2H2O;
②控制反应温度60℃,采取水浴加热,需要用温度计控制温度;
③CO2在较高温度下发生爆炸、且熔点低,应用冷水吸收;
④B为尾气处理,用碱液吸收,反应生成亚氯酸盐和氯酸盐;
⑤取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液;
(3)①在暗处静置是为了使ClO2与KI充分反应,防止ClO2分解,若不静置,ClO2反应不完全;
②ClO2溶液与碘化钾反应的离子方程式:2ClO2+10I-+8H+=5I2+2Cl-+4H2O,由I2+2S2O32-=2I-+S4O62-,可得ClO2~5S2O32-,据此计算.
解答 解:(1)二氧化氯的熔点较低、易挥发,遇光易爆炸,保存液态ClO2的条件是密封、低温避光,
故答案为:低温避光;
(2)①KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,反应方程式为:2KClO3+H2C2O4+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+2CO2↑+2KHSO4+2H2O,KClO3是氧化剂,H2C2O4是还原剂,二者物质的量之比为2:1,
故答案为:KHSO4;2:1;
②控制反应温度60℃,温度低于100℃采取水浴加热,应用温度计控制温度,
故答案为:水浴加热;温度计;
③CO2在较高温度下发生爆炸、且熔点低,应用冷水吸收,
故选:b;
④B为尾气处理,用碱液吸收,反应生成亚氯酸盐和氯酸盐,反应离子方程式为:2ClO2+2OH-=ClO3-+ClO2-+H2O,
故答案为:2ClO2+2OH-=ClO3-+ClO2-+H2O;
⑤设计实验证明溶液含SO42-:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀,
故答案为:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀;
(3)①在暗处静置是为了使ClO2与KI充分反应,防止ClO2分解,若不静置,ClO2反应不完全,生成的碘偏小,故测得的结果就偏小,故答案为:偏小;
②ClO2溶液与碘化钾反应的离子方程式:2ClO2+10I-+8H+=5I2+2Cl-+4H2O,由I2+2S2O32-=2I-+S4O62-,可得ClO2~5S2O32-,设原ClO2溶液物质的量浓度为x mol/L,则:
x mol/L×0.01L×$\frac{10mL}{100mL}$=V×10-3L×cmol/mol×$\frac{1}{5}$,
解得x=0.2cV,
则原ClO2溶液的浓度为0.2cV mol/L×67.5g/mol=13.5cV g/L,
故答案为:13.5cV.
点评 本题考查物质实验制备方案、对题目信息的迁移应用、物质的分离提纯、滴定应用等,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:
神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题:
A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
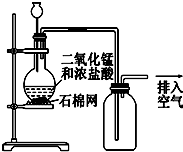
| A. | 该装置图中至少存在三处明显错误 | |
| B. | 该实验中收集氯气的方法不正确 | |
| C. | 如果需要得到干燥纯净的Cl2,只需在气体发生装置和收集装置之间连接一个装有浓硫酸的洗气瓶即可 | |
| D. | 含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当m2-m3=2.96 g时,Fe3O4的质量至少为2.32g | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 要确定混合物中是否含有Al,可取A加入适量稀盐酸 | |
| D. | 当m1>m2时,溶液a中的阴离子只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水被称为绿色氧化剂,是因为其还原产物通常为O2,对环境没有污染 | |
| B. | 王水是浓硫酸和浓硝酸按体积比3:1配成的混合物,可以溶解Au、Pt | |
| C. | 氨水显弱碱性,浓度越大密度越大 | |
| D. | 新制备的氯水中存在三种分子,四种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| C. | CO2的水溶液:c(HCO3-)>c(H+)>c(CO32-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
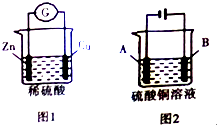
| A. | 图1装置将化学能转化为电能,电子由锌极经过稀硫酸进入铜极 | |
| B. | 利用图2装置可进行粗铜的精炼,则粗铜做A极 | |
| C. | 若A、B两电极均为铜,利用图2装置电解硫酸铜溶液,则电解后溶液的pH不变 | |
| D. | 利用图2装置可在铁上镀铜,则铁作B极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com