
| A、D>C>B>A |
| B、B>C>A>D |
| C、B=C>A>D |
| D、B=C>D>A |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 4g |
| 100g+2.2g |
| 8g |
| 100g+6.2g |
| 8g |
| 100g+6.2g |
| 4g |
| 100g+4g |


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
| OH- |
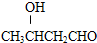
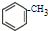
| KMnO4(H+) |
| △ |
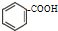
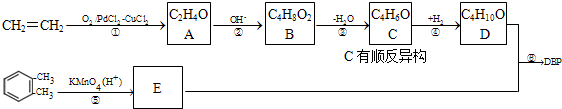
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中NH4NO3只作氧化剂 |
| B、ZnO是还原产物 |
| C、水在反应中可能起催化作用 |
| D、每生成1mol N2共转移8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ |
| B、④③①②⑤ |
| C、③④①②⑤ |
| D、⑤①③④② |
查看答案和解析>>
科目:高中化学 来源: 题型:
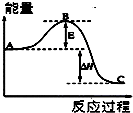 运用化学反应原理研究氮及其化合物的反应有重要意义.
运用化学反应原理研究氮及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
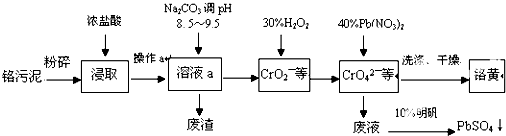
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1H、D+、T2互为同位素 |
| B、H2O、CH3COOH、NH4HCO3都是电解质 |
| C、铝、铁、铜三者对应的氧化物均为碱性氧化物 |
| D、有单质参加的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com