
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
A. 等于1.8 s B. 等于1.2 s C. 大于1.8 s D. 小于1.8 s
科目:高中化学 来源: 题型:
【题目】图1为某套实验装置的示意图,其中加热装置和部分药品等均已省略(装置Ⅰ和装置Ⅱ为气体发生装置)。
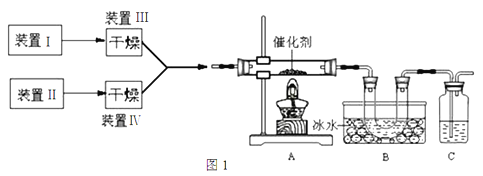
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)
制备NO2并验证其性质。
①装置Ⅰ用于实验室制备NH3,装置Ⅱ制备过量O2。装置Ⅰ中发生反应的化学方程式为_____________________。
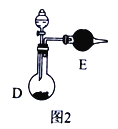
②也可以将制气体装置Ⅰ、Ⅱ、Ⅲ、Ⅳ合并为一个装置,如图2所示。若分液漏斗中盛装浓氨水,则D中的固体试剂为_______(填化学式),E中的试剂为____________。
(2)乙同学用此套装置合成SO3,B装置U形管中有固体出现。
①实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。 若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有25.0%的亚硫酸钠(质量分数)被氧化为硫酸钠,则至少需称取该亚硫酸钠的质量为______g(保留一位小数)。
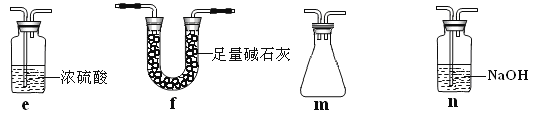
②现欲制得纯净干燥的SO3,若图1装置C中盛放NaOH溶液,则此装置中存在明显不足:
a.C中的水蒸气可能进入B中与SO3反应;b.____________________________________。
应如何改进:______________________________(从下图给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置Ⅰ、装置Ⅱ分别制取NO和NH3),将图1装置中A、B、C分别换成图5中装置Ⅴ、Ⅵ、Ⅶ。
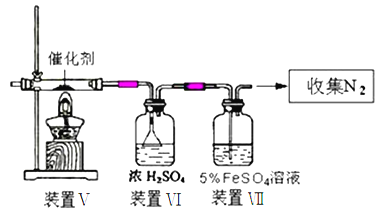
①写出氨气被NO氧化的化学方程式:___________________________。
②装置Ⅶ的作用可能是__________________________。
③若进入装置Ⅴ的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到11.2LN2,则NO的转化率是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -116 |
回答下列问题:
(1)写出该实验过程中发生的所有主要反应的化学方程式____;
在此制各实验中,要尽可能迅速地把反应温度170℃左右,其最主要目的是___(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入__,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层,若产物中有少量未反应的Br2,最好用____洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(4)若产物中有少量副产物乙醚。可用____的方法除去,加热方式为____。
(5)反应过程中应用___冷却装置D
A.冰水混合物 B.室温下的水 C.60℃ D.100℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基苯甲酸乙酯广泛用于食品、化妆品、医药等领域。某化学兴趣小组通过查阅文献,制备羟基苯甲酸乙酯。回答下列问题:
(一)对羟基苯甲酸乙酯的合成
实验原理: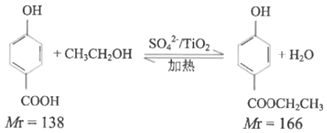
实验步骤:取0.4mol乙醇和催化剂置于干燥的仪器A中,0.1mol对羟基苯甲酸置于恒压滴液漏斗C中,实验装置如图所示(加热和夹持装置省略)。加热回流,充分反应。
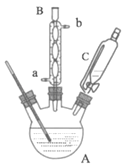
(1)仪器A的名称是_____。仪器B中冷凝水的流向为从_____(“a”或“b”)通入。
(2)某同学准备在仪器A和球形冷凝管之间加一个脱水装置,用化学平衡原理解释这样做的优点是_____。
(3)取催化剂2g,对羟基苯甲酸0.1mol,乙醇0.4mol,反应过程中酯的产率与反应时间的关系如下表所示:
反应时间/小时 | 1 | 3 | 4 | 5 | 6 |
酯的产率/% | 45.6 | 88 | 91.8 | 91.1 | 90.8 |
根据表中数据可知,最佳反应的时间应为_____;反应时间过长,产率有所下降的可能原因是_____。
(二)对羟基苯甲酸乙酯的精制
实验方法:①反应完毕后趁热滤出催化剂,滤液倒入冷水中,析出固体,过滤。
②固体先后用5%的Na2CO3溶液和水洗涤,干燥后得到粗产品。
③在装有冷凝管的圆底烧瓶中,按照一定比例加入粗品酯、乙醇、水和活性炭,加热回流0.5小时,趁热抽滤,滤液冷却,析出白色晶体,于80℃烘干。
(4)在②中用5%的Na2CO3溶液洗涤的目的是_____,能不能用NaOH溶液替代?_____(填“能”或“不能”)。
(5)在③趁热抽滤主要除去的杂质为_____,“趁热”的目的是_____。
(6)该小组同学按(3)中数据投料,最后得到对羟基苯甲酸乙酯14.9g,则该实验的产率为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科研工作者合成了一种含Si新型阻燃剂F,其合成路线如图:

回答下列问题:
(1)在质谱图中,A的最大质荷比为_____。
(2)B的结构简式为_____,D中所含官能团名称为_____。
(3)C到D的化学反应方程式为_____,反应类型_____。
(4)A有多种同分异构体,其中一种为链状结构,核磁共振氢谱显示有两组峰,且峰面积之比为2:1,其结构简式为_____。
(5)已知:![]() ,根据上述流程,以ClCH2CH=CH2和对甲基苯酚为原料制备
,根据上述流程,以ClCH2CH=CH2和对甲基苯酚为原料制备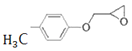 ,写出合成路线_____(无机试剂任选)。
,写出合成路线_____(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为气相直接水合法C2H4(g)+H2O(g)![]() C2H5OH(g)中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
C2H5OH(g)中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
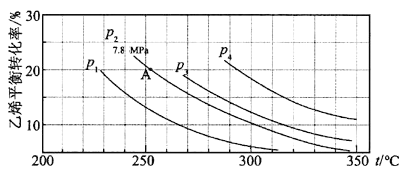
计算乙烯水合制乙醇反应在图中A点的平衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
A.0.082B.0.072C.0.072MPa-1D.0.082 MPa-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
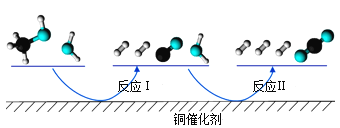
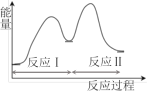
下列说法正确的是( )
A.反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.选择优良的催化剂降低反应Ⅰ和Ⅱ的活化能,有利于减少过程中的能耗
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol/L的NH4Cl溶液中,离子浓度关系正确的是
A.c(![]() )>c(Cl—)>c(H+)>c(OH—)
)>c(Cl—)>c(H+)>c(OH—)
B.c(![]() )>c(OH—)>c(Cl—)>c(H+)
)>c(OH—)>c(Cl—)>c(H+)
C.c(OH—)=c(Cl—)+c(H+)
D.c(![]() )+c(H+)=c(Cl—)+c(OH—)
)+c(H+)=c(Cl—)+c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
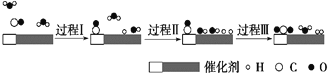
下列说法正确的是( )
A.图示显示:起始时的2个H2O最终都参与了反应
B.过程Ⅰ、过程Ⅱ均为放热过程
C.过程Ⅲ只生成了共价化合物
D.使用催化剂降低了水煤气变换反应的ΔH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com