
【题目】对羟基苯甲酸乙酯广泛用于食品、化妆品、医药等领域。某化学兴趣小组通过查阅文献,制备羟基苯甲酸乙酯。回答下列问题:
(一)对羟基苯甲酸乙酯的合成
实验原理: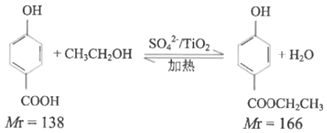
实验步骤:取0.4mol乙醇和催化剂置于干燥的仪器A中,0.1mol对羟基苯甲酸置于恒压滴液漏斗C中,实验装置如图所示(加热和夹持装置省略)。加热回流,充分反应。
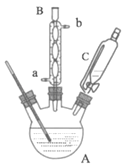
(1)仪器A的名称是_____。仪器B中冷凝水的流向为从_____(“a”或“b”)通入。
(2)某同学准备在仪器A和球形冷凝管之间加一个脱水装置,用化学平衡原理解释这样做的优点是_____。
(3)取催化剂2g,对羟基苯甲酸0.1mol,乙醇0.4mol,反应过程中酯的产率与反应时间的关系如下表所示:
反应时间/小时 | 1 | 3 | 4 | 5 | 6 |
酯的产率/% | 45.6 | 88 | 91.8 | 91.1 | 90.8 |
根据表中数据可知,最佳反应的时间应为_____;反应时间过长,产率有所下降的可能原因是_____。
(二)对羟基苯甲酸乙酯的精制
实验方法:①反应完毕后趁热滤出催化剂,滤液倒入冷水中,析出固体,过滤。
②固体先后用5%的Na2CO3溶液和水洗涤,干燥后得到粗产品。
③在装有冷凝管的圆底烧瓶中,按照一定比例加入粗品酯、乙醇、水和活性炭,加热回流0.5小时,趁热抽滤,滤液冷却,析出白色晶体,于80℃烘干。
(4)在②中用5%的Na2CO3溶液洗涤的目的是_____,能不能用NaOH溶液替代?_____(填“能”或“不能”)。
(5)在③趁热抽滤主要除去的杂质为_____,“趁热”的目的是_____。
(6)该小组同学按(3)中数据投料,最后得到对羟基苯甲酸乙酯14.9g,则该实验的产率为_____%。
【答案】三颈烧瓶 a 除水,以利于平衡正方向移动,提高产率 4小时 副反应增多或原料损失增加 除去剩余的对羟基苯甲酸和乙醇,析出对羟基苯甲酸乙酯 不能 活性炭 减少对羟基苯甲酸乙酯的耗损 89.8
【解析】
(1)根据仪器构造可得;冷凝管通水下进上出;
(2)为了提高产率需要使平衡正向移动;
(3)选择产率最高的时间;副反应或反应物的减少均会导致产率下降;
(4)除去催化剂的滤液主要成分为产物对羟基苯甲酸乙酯,混有剩余的反应物对羟基苯甲酸和乙醇,对羟基苯甲酸和乙醇溶于碳酸钠溶液;强碱性环境酯类物质水解;
(5)过滤除去难溶物;考虑减少产物的损耗;
(6)对羟基苯甲酸0.1mol,乙醇0.4mol,乙醇过量,则理论上生成的产物为0.1mol,据此计算。
(1)仪器A为三颈烧瓶;仪器B中冷凝水的流向为从a流入;
(2)反应有水生成,在仪器A和球形冷凝管之间加一个脱水装置,可以除水,以利于平衡正方向移动,提高产率;
(3)由图表可知,4小时的产率最高,最佳反应时间为4小时;反应时间过长,副反应增多或原料损失增加会使产率有所下降;
(4)除去催化剂的滤液主要成分为产物对羟基苯甲酸乙酯,混有剩余的反应物对羟基苯甲酸和乙醇,对羟基苯甲酸和乙醇溶于碳酸钠溶液,故在②中用5%的Na2CO3溶液洗涤的目的是除去剩余的对羟基苯甲酸和乙醇,同时降低对羟基苯甲酸乙酯的溶解度,析出对羟基苯甲酸乙酯;不能用NaOH溶液替代,因为产物为酯类物质,会水解损失;
(5)活性炭为难溶物,趁热过滤可除去活性炭;为防止对羟基苯甲酸乙酯析出,应趁热过滤;
(6)对羟基苯甲酸0.1mol,乙醇0.4mol,乙醇过量,则理论上生成的产物为0.1mol,则该实验的产率为=![]() =89.8%。
=89.8%。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案科目:高中化学 来源: 题型:
【题目】50mL 18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量
A. 小于0.45mo1B. 等于0.45molC. 在0.45mol和0.9mol之间D. 大于0.9mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子和少量的尿素[CO(NH2)2].利用该卤块为原料生产轻质氧化镁的工艺流程如图:

当相关金属离子[c0(Mn+)=0.1molL﹣1]时,形成氢氧化物沉淀的pH范围如表:
金属离子 | Fe2+ | Fe3+ | Mn2+ | Mg2+ |
开始沉淀的pH | 7.6 | 2.7 | 8.3 | 9.6 |
沉淀完全的pH | 8.3 | 3.7 | 9.8 | 11.1 |
回答下列问题:
(1)NaClO中氯元素的化合价为_____。NaClO为漂白液的主要成分,写出制备漂白液的离子方程式_____。
(2)若溶液b中杂质离子的浓度均为0.1molL﹣1,若要使杂质离子沉淀完全,步骤③应溶液的pH调节至_____,沉淀物A含有Mn(OH)2和_____。
(3)若在实验室中完成步骤⑥,则沉淀物C应在_____(填仪器名称)中灼烧。写出步骤⑥的化学方程式_____。
(4)步骤②加入NaClO还能除去卤块中的尿素[CO(NH2)2],生成一种盐和两种无毒气体及水,其化学方程式为_____,若除去卤快中含有的0.02molCO(NH2)2,需消耗NaClO的质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( )
4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( )
A.ν(H2O)=0.6 mol/(L·s)B.ν(O2)=0.72 mol/(L·s)
C.ν(NO)==0.9 mol/(L·s)D.ν(NH3)=0.4 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 0.2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是
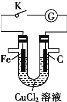
A.打开K,铁棒上有紫红色物质析出
B.闭合K,碳棒上有紫红色固体析出
C.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为9.6 g
D.闭合K,铁棒表面发生的电极反应为Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可根据烷烃的同分异构体判断卤代烃的种数。步骤如下:
①利用减碳移位法书写出对应烷怪的同分异构体:
②判断各同分异构体中等效氢的数目。判断等效氢的规律为同一碳原子上的氢原子等效;同一碳原子上的甲基氢原子等效;位于对称位置上的碳原子上的氢原子等效。
③用卤素原子取代等效氢原子,有几种不同的氢,其一元取代物就有几种。
分子式为C5H11Cl的同分异构体共有(不考虑立体异构)
A.6种B.7种C.8种D.9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
A. 等于1.8 s B. 等于1.2 s C. 大于1.8 s D. 小于1.8 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是
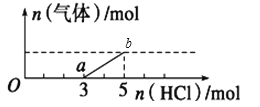
A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.a点溶液中能使酚酞溶液变红
C.标准状况下,通入CO2的体积为44.8L
D.原NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com