
����Ŀ��ʵ��������460mL0.1mol/LNaOH��Һ���ش��������⣺
��1����ɱ�ʵ��������������У�������ƽ��ҩ�ס��ձ�������������Ͳ��_____��_____�ȡ�
��2��Ӧ��������ƽ��ȡNaOH���������Ϊ_________��
��3����������������NaOH��ҺŨ��ƫ�ߵ���_________________
A .�������õ�NaOH�������С�ձ����ܽ⣬δ����ȴ����ת�Ƶ�����ƿ�в�����
B .ҡ�Ⱥ���Һ����ڿ̶��ߣ��μ�����ˮ���̶�����ҡ��
C .����ʱ��������ƿ�Ŀ̶���
D������ƿ�ڱڸ���ˮ���δ���ﴦ��
E�� NaOH��������ձ��г���ʱ�����
��4��ȡ���������Ϊ150mL�� A��B ����NaOH ��Һ���ֱ�ͨ��һ������ CO2 ������������Һ�еμ�һ�����ʵ���Ũ�ȵ����� , ���� CO2 �����(��״��)����������������ϵ��ͼ��ʾ��
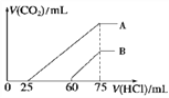
��B ���߱�����ԭ��Һͨ��CO2��������Һ�����ʵĻ�ѧʽΪ______________��
��A ���߱����������Ũ��Ϊ______mol/L��ͨ���CO2�ڱ�״���µ����Ϊ______mL��
���𰸡� 500mL����ƿ ��ͷ�ι� 2.0g AC Na2CO3 ��NaOH 0.2 224
�����������������ʵ��������460mL0.1mol/LNaOH��Һ����Ҫѡ��500ml����ƿ����500ml��Һ��������Ҫ0.05mol NaOH��������Ϊ2.0g��
��1����ɱ�ʵ��������������У�������ƽ��ҩ�ס��ձ�������������Ͳ��500mL����ƿ����ͷ�ιܵȡ�
��2��Ӧ��������ƽ��ȡNaOH���������Ϊ2.0g��
��3��A .�������õ�NaOH�������С�ձ����ܽ⣬δ����ȴ����ת�Ƶ�����ƿ�в���������������Һ���ƫС��Ũ��ƫ����B .ҡ�Ⱥ���Һ����ڿ̶��ߣ��μ�����ˮ���̶�����ҡ������������Һ���ƫ��Ũ��ƫ�ͣ�C .����ʱ��������ƿ�Ŀ̶�������������Һ���ƫС��Ũ��ƫ�ߣ� D������ƿ�ڱڸ���ˮ���δ���ﴦ������������Һ��Ӱ�죻E�� NaOH��������ձ��г���ʱ��������������NaOH�����տ����е�ˮ�Ͷ�����̼��ƫС����������Һ��Ũ��ƫ�͡������������������NaOH��ҺŨ��ƫ�ߵ���AC ��
��4��ȡ���������Ϊ150ml�� A��B ����NaOH ��Һ����ÿ����Һ�к���0.015molNaOH���ֱ�ͨ��һ������ CO2 ������������Һ�еμ�һ�����ʵ���Ũ�ȵ����� , ����ͨ����ٶ�����̼��������75mL���ᶼǡ�õõ��Ȼ�����Һ�����������غ���������غ��֪��c(HCl)= ![]() 0.2mol/L������Һ�м���������Һ���Ⱥ����ķ�Ӧ����Ϊ��HCl+NaOH=NaCl+H2O����Na2CO3+HCl=NaHCO3+NaCl����NaHCO3+HCl=NaCl+CO2��+H2O����B ���߱�������Ӧ������15mL������75-60������Ӧ�ٺͷ�Ӧ�ڹ�����60mL���ᣬ��Ϊ�������ƺ�̼�����Ʋ��ܴ������棬����ԭ��Һͨ��CO2��������Һ�����ʵĻ�ѧʽΪNa2CO3��NaOH��
0.2mol/L������Һ�м���������Һ���Ⱥ����ķ�Ӧ����Ϊ��HCl+NaOH=NaCl+H2O����Na2CO3+HCl=NaHCO3+NaCl����NaHCO3+HCl=NaCl+CO2��+H2O����B ���߱�������Ӧ������15mL������75-60������Ӧ�ٺͷ�Ӧ�ڹ�����60mL���ᣬ��Ϊ�������ƺ�̼�����Ʋ��ܴ������棬����ԭ��Һͨ��CO2��������Һ�����ʵĻ�ѧʽΪNa2CO3��NaOH��
��A ���߱����������Ũ��Ϊ0.2 mol/L����Ӧ��������������Ϊ��75-25��mL=50mL����n(CO2)=n(HCl )=0.2mol/L![]() 0.05L=0.01mol������ͨ���CO2�ڱ�״���µ����Ϊ224mL��
0.05L=0.01mol������ͨ���CO2�ڱ�״���µ����Ϊ224mL��


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���� �� ��
A. ���ۺ���ά�ض��Ǵ�����
B. ��֬������ʹ������Ȼ�̼��Һ��ɫ
C. ���Ǻ͵��۶�����ʹ����������ͭ�ڼ��������»�ԭ�ɺ�ɫ����
D. ��ë��������Ҫ�ɷֶ��ǵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״���£�2.24LHF����������Ϊ0.1NA
B. ij�¶��£�2LpH=12��NaOH��Һ�к�OH-����ĿΪ0.02NA
C. ��ϩ�ͻ�������ɵ�42g�����������й��õ��Ӷ�����Ϊ9NA
D. ��ѧ��Ӧ��ÿ����1molO2��ת�Ƶĵ�����Ϊ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��Һ����س��ʱ��̣���������ǿ������Ϊ��������ء�������ԭ����ͼ1��ʾ����Ӧ�����ӷ���ʽΪ:VO2++V3++H2O![]() VO2++V2++2H+���Դ˵�ص��Na2SO3��Һ(�缫����Ϊʯī),������NaOH��ͬʱ�õ�H2SO4����ԭ����ͼ2��ʾ������˵���������
VO2++V2++2H+���Դ˵�ص��Na2SO3��Һ(�缫����Ϊʯī),������NaOH��ͬʱ�õ�H2SO4����ԭ����ͼ2��ʾ������˵���������
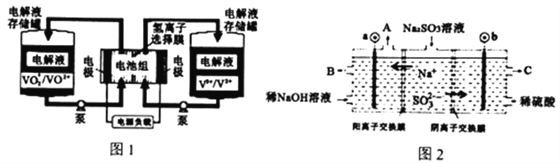
A. ���Na2SO3��Һʱ,a�����ظ�������,ͼ1��H+�ӵ���ұ��������
B. ��س��ʱ,�����缫��ӦΪVO2++e-+2H+=VO2++H2O
C. ���ʱb�ĵ缫��ӦʽΪSO32-+H2O-2e-=SO42-+2H+
D. ����������ͼ2����Һ��������ܱգ�������12.6gNa2SO3,�������仯������Ϊ4.4g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A��Է�������Ϊ136������ʽΪC8H8O2��A�ĺ˴Ź���������4���������֮��Ϊ1��2��2��3��A������ֻ��һ�������ұ�����ֻ��һ��ȡ����������������˴Ź�����������ͼ������A������˵���У���ȷ������ ��
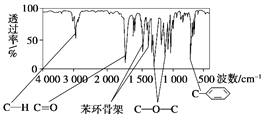
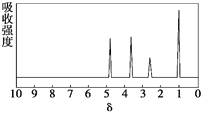
A. ��������A���ӽṹ�������л���ֻ��1��
B. A����������������������ˮ�������FeCl3��Һ����ɫ
C. A��һ�������¿���4 mol H2�����ӳɷ�Ӧ
D. ��A����ͬ������ͬ���칹��ֻ��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.NH3��ˮ��Һ�ܵ��磬����NH3�ǵ����
B.BaSO4��ˮ��Һ���������磬��BaSO4�ǵ����
C.Һ�岻���磬����Һ���Ƿǵ����
D.ʳ��ˮ�ܵ��磬�������ڵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ-ѡ��5:�л���ѧ����]��̽���һ�ֺϳ�·����ͼ:
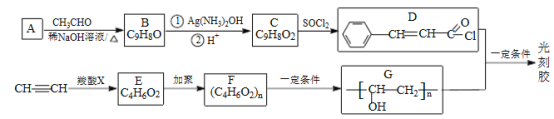
��֪:
I. 
��. ![]()
��.RCOOH+CH��CH��RCOOCH=CH2
��.�Ȼ����������������������ӳɷ�Ӧ��
�ش���������:
(1)A��������_____��C �����������ŵ�������__________��
(2)��C����D����Ȳ����E�ķ�Ӧ���ͷֱ�Ϊ_____ ��_____ ��
(3)E�Ľṹ��ʽΪ_____ ��
(4)D+G����̽��Ļ�ѧ����ʽΪ__________��
(5)T��C��ͬ���칹��,T �����������ʻ�����: ���ܷ���ˮ�ⷴӦ��������Ӧ������ʹ��ˮ��ɫ�������ڷ����廯������к˴Ź�������Ϊ5���,�ҷ������Ϊ1:1:2:2:2�Ľṹ��ʽΪ_____________��
(6)д������ȩ�ͱ�ȲΪԭ���Ʊ�������CH3CH2CH2COOCH2CH2CH3�ĺϳ�·��__________________(�����Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��84����Һ��ƿ�岿�ֱ�ǩ��ͼ��ʾ���á�84����Һ��ͨ��ϡ��100��(���֮��)
��ʹ�á���ش��������⣺

��1���á�84����Һ�������ʵ���Ũ��ԼΪ_____mol��L��1��
��2��ȡ����������ĸ�����Һʱ�������������л�����ȡ����Ķ��ٶ��仯����________(����ĸ)��
A����Һ��NaClO�����ʵ��� B����Һ��Ũ��
C����Һ��NaClO��Ħ������ D����Һ���ܶ�
��3����ͬѧ���ĸá�84����Һ�����䷽������NaClO��������480 mL��NaClO��������Ϊ25%������Һ���ش��������⡣
����ͼ��ʾ�������У���Щ�Dz���Ҫ������������Һ����Ҫ_____________��������

����Ҫ����NaClO���������Ϊ_______ g
��4����84����Һ����ϡ������ʹ�ÿ���ǿ����������ij����С����Ա��98%(�ܶ�Ϊ1.84 g��cm��3)��Ũ��������200 mL 2.3 mol��L��1��ϡ����������ǿ��84����Һ��������������
�������Ƶ�ϡ�����У�H�������ʵ���Ũ��Ϊ________ mol��L��1��
������Ũ��������Ϊ________ mL��
���������Ƶ�ϡ����Ũ��ƫС�������п��ܵ�ԭ���������ȷ����_______��
A������ǰ������ƿ������������ˮ B����ȡŨ����ʱ������Һ��İ�Һ��
C��δ��ȴ������ת��������ƿ���� D������ʱ��������Һ�İ�Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ħ�������� ______ �����������е�����![]() ���ţ� ______
���ţ� ______ ![]() ��λ�� ______ �� ______ ��
��� ______ �� ______ ��
A. ��λ���ʵ�����M��![]() ��
��![]()
B. ���ʵ�����m��![]() ��
��![]()
C. ��λ���ʵ�����m��g��![]()
D. ���ʵ�����M��![]() ��kg
��kg
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com