
 (1)
(1) 的名称是
的名称是
(2)写出右图化合物A中含氧官能团的名称
(3)某物质的实验式是Co(NH3)5BrSO4,向它的溶液中加入BaCl2溶液时,无明显现象;加入强碱处理,也无气体放出。若加入 AgNO3溶液时,产生淡黄色沉淀。写出它的配位化学式 。
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
在体积不变的密闭容器中,2A(g)+2B(g) 3C(g)+D(g)达到平衡状态的标志是.
3C(g)+D(g)达到平衡状态的标志是.
A.单位时间内生成2n mol A,同时生成n mol D
B.容器内压强不随时间而变化
C.单位时间内生成n mol B,同时消耗1.5n mol C
D.容器内混合气体密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器内,可逆反应: ,达到平衡状态的标志是:
,达到平衡状态的标志是:
(1)单位时间内生成 的同时生成
的同时生成
(2)单位时间内生成 的同时生成
的同时生成
(3)用 的物质的量浓度变化表示反应速率的比为2:2:1的状态
的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A. (1)(3)(4) B. (2)(3)(5)
C. (1)(4)(5) D. (1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2、BF3、CCl4都是非极性分子,NH3、H2S都是极性分子,由此推出ABn型分子是非极性分子的经验规律,正确的是( )
A.所有原子在同一平面内 B.分子中不含有氢原子
C.A的化合价的数值等于其最外层电子数 D.分子结构对称
查看答案和解析>>
科目:高中化学 来源: 题型:
Ni、K和F三种元素组成的一个化合物的晶胞如右图所示。该化合物的化学式及Ni的配位数为( )
A.K2NiF4;6 B.K4Ni2F8;8 C.K2NiF3;4 D.K2NiF6;6

查看答案和解析>>
科目:高中化学 来源: 题型:
某金属晶体M有两种堆积形式,如下图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同。

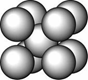
甲 乙
(1)乙的堆积方式称为 堆积;
甲和乙两种堆积方式中配位数之比为 ,晶胞边长之比为 。
(2)在T℃以下测定该金属晶体有关性质参数如下表所示。已知原子化热指1mol金属由固态转变为气态原子时所需要吸收的热量,是衡量金属键强弱的物理量。
| 金属 | 相对原子质量 | 密度/g·㎝-3 | 原子化热/kJ·mol-1 |
| Na | 22. 99 | 0. 960 | 108. 4 |
| M | 60. 20 | 7. 407 | 7735 |
预测该金属的熔点比Na (填“高”或“低”),由上述数据可计算M原子的原子半径为 pm。
(已知 ,7. 407≈
,7. 407≈ ,1pm=10
,1pm=10 m)
m)
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )
A.3 mol·L-1 HCl B.4 mol·L-1 HNO3
C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生
0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 ( )
A.3 mL B.7.5 mL
C.15 mL D.17.5 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com