
分析 (1)根据盐酸和氢氧化钠混合溶液中pH计算氢氧化钠浓度,混合后溶液中剩余氢氧根离子;
(2)氢氧化钠和HA以1:1反应,NaOH溶液12.5mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA,则氢氧化钠和HA的物质的量相等,结合氢氧化钠和HA的关系式计算HA的浓度;
(3)电离平衡常数K=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$.
解答 解:(1)设氢氧化钠的浓度为xmol/L,盐酸和氢氧化钠混合溶液中c(OH-)=$\frac{2x-0.05×1}{1+2}$mol/L=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L,$\frac{2x-0.05×1}{1+2}$=0.01,x=0.04,
故答案为:0.04mol/L;
(2)氢氧化钠和HA以1:1反应,NaOH溶液12.5mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA,则氢氧化钠和HA的物质的量相等,
设HA的浓度为ymol/L,
0.04mol/L×0.0125L=ymol/L×0.002L,
y=$\frac{0.04×0.0125}{0.002}$=0.025,
故答案为:0.025 mol/L;
(2)电离平衡常数K=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.025-1{0}^{-3}}$=4.5×10-5,故答案为:4.5×10-5.
点评 本题考查了pH的简单计算、电离平衡常数的计算等知识点,根据物质间的关系、混合溶液的pH、电离平衡常数公式等知识点来分析解答即可,注意酸碱混合溶液中pH的计算方法,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,2.24 L苯含有的分子数为0.1NA | |
| B. | 100ml 1mol/L的NH4Cl溶液中,NH4+的数目为0.1NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
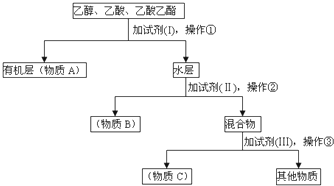
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
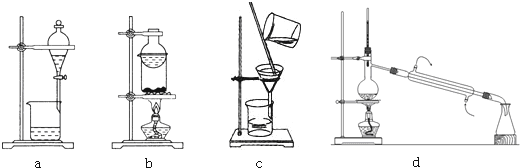
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
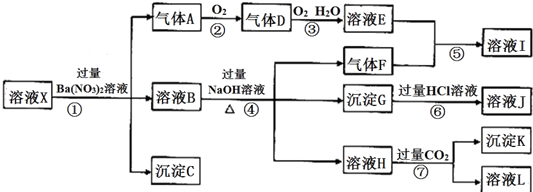
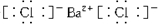 ,③的电子式是
,③的电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘-131原子核外有5个电子层 | |
| B. | 碘-131原子的最外层有7个电子 | |
| C. | 具有放射性的碘-131原子比普通碘-127原子多4个中子 | |
| D. | 131I2与127I2互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
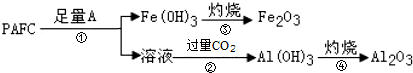
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,BA2的结构式是:S=C=S.
,BA2的结构式是:S=C=S.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com