
分析 碳酸钠溶液中碳酸根离子水解显碱性,水解过程是吸热反应,加热促进水解进行,碳酸钠和氯化钡溶液混合反应生成碳酸钡沉淀.
解答 解:碳酸钠溶液中碳酸根离子水解显碱性,滴入酚酞试液变红色,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,水解过程是吸热反应,加热促进水解进行溶液碱性增强,所以溶液红色加深;碳酸钠和氯化钡溶液混合反应生成碳酸钡沉淀,反应的离子方程式为:Ba2++CO32-=BaCO3↓,
故答案为:变红色;CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;红色加深;生成白色沉淀;Ba2++CO32-=BaCO3↓.
点评 本题考查了盐类水解的分析判断,主要是水解平衡影响因素的分析应用,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 蛋白质溶液中加入硫酸铜溶液,有白色沉淀产生,加水,白色沉淀重新溶解 | |
| C. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| D. | 分子式为C2H4O2与C4H8O2的两种物质一定属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石蕊变红色的溶液:Na+、Mg2+、Cl-、SO42- | |
| B. | 能溶解氧化铝粉末的溶液中:K+、N03-、Cl-、NH4+ | |
| C. | 滴加苯酚溶液显紫色的溶液:NH4+、K+、Cl-、H2S | |
| D. | 由水电离出的c(H+)=10-12mol.L-1的溶液:Na+、K+、NO3-、C6H5O- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4的电离:NaHSO4=Na++H++SO${\;}_{4}^{2-}$ | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
| C. | S2-的结构示意图: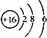 | |
| D. | 质子数为94,中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.5mol•L-1 NH4NO3溶液中含氮原子数目6.02×1023 | |
| B. | 标准状况下,22.4L C3H8含有C-H键的数目为6.02×1023 | |
| C. | 32g SO2与足量O2混合充分反应,转移的电子数目为6.02×1023 | |
| D. | 常温下,500mL pH=0的硫酸溶液中含有的H+数目为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2 | |
| B. | 向盐酸中滴加氨水:H++OH-=H2O | |
| C. | 向KI溶液中通入少量Cl2:Cl2+2I-=2Cl-+I2 | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO4 2-=CaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.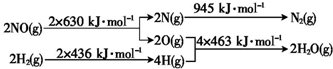
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解. 操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中. 操作3:继续向X中加蒸馏水至液面 离X的刻度线l~2cm处. |
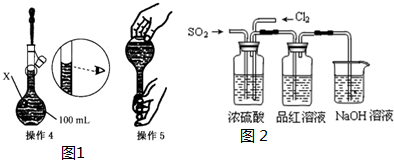
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com