
【题目】短周期元素A、B、C、D、E、F的原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为1s22s22p6,A原子核外有2个未成对电子,且无空轨道,C单质可与热水反应但很难与冷水反应;E、F原子在基态时填充电子的轨道数为9,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子。
(1)上述六种元素中,第一电离能最大的是__(填元素符号),理由是__。
(2)比较C、D元素的第一电离能:__>__(填元素符号),理由是__。
(3)题述六种元素的电负性由小到大的顺序为__。
(4)C、D、E、F元素形成的最高价氧化物是离子化合物的有__(填化学式,下同),是共价化合物的有__。
【答案】F ![]() 其原子的最外层电子数为7,且原子半径小,容易得到电子,不容易失去电子 Mg Al 镁原子最外层3s轨道处于全满状态,是相对稳定的结构 Mg<Al<P<S<O<F MgO、Al2O3 P2O5、SO3
其原子的最外层电子数为7,且原子半径小,容易得到电子,不容易失去电子 Mg Al 镁原子最外层3s轨道处于全满状态,是相对稳定的结构 Mg<Al<P<S<O<F MgO、Al2O3 P2O5、SO3
【解析】
短周期元素A、B、C、D、E、F的原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O,B为F,C单质可与热水反应但不能与冷水反应,则C为Mg,D为Al,E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P,F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S;以此解答。
(1)越是容易得到电子的原子则越不容易失去电子,在这六种元素中,最易得电子的是F,所以其电离能最高;
(2)由分析可知C为Mg,D为Al,镁原子最外层3s轨道处于全满状态,是相对稳定的结构,故第一电离能:Mg>Al;
(3)同主族元素的原子电负性从上到下逐渐减小,同一周期元素原子的电负性从左到右逐渐增大,所以六原子的电负性顺序是:Mg<Al<P<S<O<F;
(4)活泼金属氧化物大多是离子化合物,非金属氧化物大多是共价化合物,所以MgO、Al2O3为离子化合物,P2O5、SO3为共价化合物。


科目:高中化学 来源: 题型:
【题目】某烷烃的相对分子质量为86,其一氯代物只有两种,则它的结构简式、名称都正确的是( )
A.![]() 己烷
己烷
B.![]() 2,3-二甲基丁烷
2,3-二甲基丁烷
C.![]() 3-甲基戊烷
3-甲基戊烷
D.![]() 2,2-二甲基丁烷
2,2-二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是处于研究阶段的“人工固氮”的新方法。N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)-1530.4kJ,完成下列填空:
4NH3(g)+3O2(g)-1530.4kJ,完成下列填空:
(1)该热化学反应方程式的意义是________________________________________。
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡时_______。
a.平衡常数K增大 b.H2O的浓度减小
c.容器内的压强增大 d.v逆(O2)减小
(3)部分实验数据见下表(条件:2L容器、催化剂、光、N21mol、水3mol、反应时间3 h):
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组容器中3小时内以NH3表示的平均反应速率是________________。第四组容器内NH3生成量最小的可能原因是_________________________________________。
(4)若用该反应进行工业生产,请选择适宜的条件___________________________ 。
(5)氨气大量用于制尿素,铵态氮肥以及硝酸,氨还可用做致冷剂。在(NH4)2SO4溶液中存在水解反应,常温下该水解反应的平衡常数表达式可表示为K=_____________。
(6)有等浓度的下列三种溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4,c(NH4+)由大到小的顺序是____________________;若换成pH值相等,则三种溶液中,c(NH4+)由大到小的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE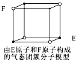
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠 [Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法不正确的是 {已知25℃,Ksp[Fe(OH)3]=2.64×10-39}
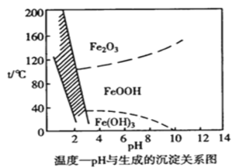
A.工业生产黄铁矾钠,温度控制在85~95℃pH=1.5左右
B.pH=6,温度从80℃升高至150℃体系得到的沉淀被氧化
C.用氯酸钠在酸性条件下氧化Fe2+ 离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
D.在25℃时溶液经氧化,调节溶液pH=4 ,此时溶液中c(Fe3+)=2.64×10-9 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图①和图②分别是1s电子的概率密度分布图和电子云轮廓图。下列认识正确的是( )

A.图①中的每个小黑点表示1个电子
B.图②表明1s电子云呈球形,有无数条对称轴
C.图②表示1s电子只能在球体内出现
D.不同能层的s电子云的半径相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物![]() ,Z元素可形成负一价离子。下列说法正确的是( )
,Z元素可形成负一价离子。下列说法正确的是( )
A.X元素原子的基态电子排布式为![]()
B.X元素是第四周期第ⅤA族元素
C.Y元素原子的电子排布图为![]()
D.Z元素的单质![]() 在氧气中不能燃烧
在氧气中不能燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,草酸(H2C2O4)的Ka1=5.4×10-2,Ka2=5.4×10-5,是一种常用的除锈剂。0.1mol/L的NaHC2O4溶液中,下列粒子的物质的量浓度关系不正确的是( )
A.c(Na+)>c(HC2O4-)>c(OH-)>c(H2C2O4)>c(H+)
B.c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
C.c(Na+)+c(H+)= c(HC2O4-)+2c(C2O42-)+c(OH-)
D.c(H+)+c(H2C2O4)= c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa= -lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。下列说法不正确的是( )
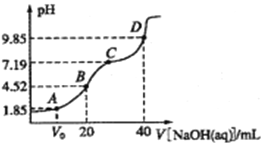
A.A点所得溶液中:Vo等于l0mL
B.B点所得溶液中:c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-)
C.C点所得溶液中:c(Na+)>3c(HSO3-)
D.D点所得溶液中水解平衡常数:Kh1=10-6.81
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com