
【题目】下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE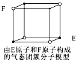
【答案】B
【解析】
A. 价电子排布为ns1的元素,为第IA族元素,一定为s区元素,故A错误;
B. Fe是26元素,其价电子数是8,每个配体CO分子提供电子数为2,则8+2n=18,解得n=5,故B正确;
C. 甲醛分子中碳原子形成了3个σ键,没有孤电子对,因此,碳原子采取sp2杂化,甲醛分子的立体构型为平面三角形,光卤气(COCl2)分子中C原子价层电子对数=3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面三角形,但是甲醛中与C原子连接的为2个H和1个O,光卤气中与C原子连接的为2个Cl和1个O,H和Cl的电负性不同,则键角不相同,故C错误;
=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面三角形,但是甲醛中与C原子连接的为2个H和1个O,光卤气中与C原子连接的为2个Cl和1个O,H和Cl的电负性不同,则键角不相同,故C错误;
D. 团簇分子中含有4个E,4个F原子,分子式应为E4F4或F4E4,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】丹参醇是一种中药成分,结构简式如图所示。下列关于丹参醇的描述正确的是

A.能与浓硫酸共热后发生消去反应
B.能与NaHCO3溶液反应放出气体
C.分子中含有2个手性碳原子
D.1 mol丹参醇最多能与5 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种难溶金属氢氧化物分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。下列说法正确的是
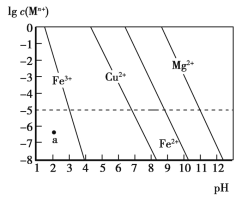
A.a点代表Fe(OH)3的饱和溶液
B.Ksp[Cu(OH)2]<Ksp[Fe(OH)2]
C.向0.1 mol·L-1Cu2+、Mg2+、Fe2+混合溶液中,逐滴滴加稀NaOH溶液,Mg2+最先沉淀
D.在pH=7的溶液中,Cu2+、Mg2+、Fe2+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,![]() 是实验室常用的一种化学试剂。下列说法中错误的是( )
是实验室常用的一种化学试剂。下列说法中错误的是( )
A.Z2Y的水溶液呈碱性
B.最简单氢化物沸点高低为:X>W
C.常见单质的氧化性强弱为:W>Y
D.![]() 中各原子最外层均满足8电子稳定结构
中各原子最外层均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,溴化银在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
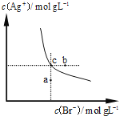
A.向溴化银悬浊液中加入溴化钠溶液,溴化银的Ksp减小
B.图中a点对应的是不饱和溶液
C.向c点对应的溶液中加入少量0.1 mol·L-1 AgNO3溶液,则c(Br-)增大
D.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为MnO2+SO2=MnSO4。已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、A13+(使其浓度均小于1×10-6 mol·L-1),需调节溶液pH范围为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性 K2Cr2O7 溶液可与 FeSO4 溶液反应生成 Fe3+和 Cr3+。现将硫酸酸化的 K2Cr2O7 溶液与 FeSO4 溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的 KI 的物质的量的变化关系如图所示,下列不正确的是
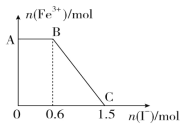
A.图中 AB 段的氧化剂为 K2Cr2O7
B.开始加入的 K2Cr2O7 为 0.25 mol
C.图中 BC 段发生的反应为 2Fe3++2I-=2Fe2++I2
D.混合之前,K2Cr2O7 与 FeSO4 的物质的量之比为 1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
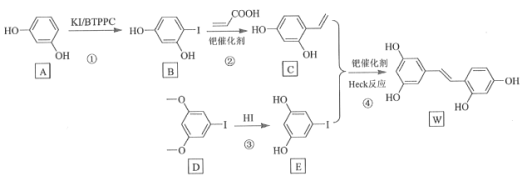
回答下列问题:
![]() 的化学名称为___________。
的化学名称为___________。
![]()
![]() 中的官能团名称是___________。
中的官能团名称是___________。
![]() 反应③的类型为___________,W的分子式为___________。
反应③的类型为___________,W的分子式为___________。
![]() 不同条件对反应④产率的影响见下表:
不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率 |
1 | KOH | DMF |
|
|
2 |
| DMF |
|
|
3 |
| DMF |
|
|
4 | 六氢吡啶 | DMF |
|
|
5 | 六氢吡啶 | DMA |
|
|
6 | 六氢吡啶 | NMP |
|
|
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
![]() 为D的同分异构体,写出满足如下条件的X的结构简式________________。
为D的同分异构体,写出满足如下条件的X的结构简式________________。
含有苯环;②有三种不同化学环境的氢,个数比为6:2:1;③1 mol的X与足量金属Na反应可生成2 g H2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com