
【题目】已知酸性 K2Cr2O7 溶液可与 FeSO4 溶液反应生成 Fe3+和 Cr3+。现将硫酸酸化的 K2Cr2O7 溶液与 FeSO4 溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的 KI 的物质的量的变化关系如图所示,下列不正确的是
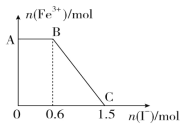
A.图中 AB 段的氧化剂为 K2Cr2O7
B.开始加入的 K2Cr2O7 为 0.25 mol
C.图中 BC 段发生的反应为 2Fe3++2I-=2Fe2++I2
D.混合之前,K2Cr2O7 与 FeSO4 的物质的量之比为 1:6
【答案】D
【解析】
将硫酸酸化的 K2Cr2O7 溶液与 FeSO4 溶液混合,发生如下反应:![]() ,向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的 KI 的物质的量的变化关系如图,可知在AB段发生反应:
,向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的 KI 的物质的量的变化关系如图,可知在AB段发生反应:![]() ,在BC段发生反应:2Fe3++2I-=2Fe2++I2。据此解答。
,在BC段发生反应:2Fe3++2I-=2Fe2++I2。据此解答。
A.在AB段发生反应:![]() ,氧化剂是K2Cr2O7,故A正确;
,氧化剂是K2Cr2O7,故A正确;
B.根据图像可知,在BC段,消耗I-0.9mol,由反应对应的关系![]() ,推知在混合时生成了0.9mol Fe3+,
,推知在混合时生成了0.9mol Fe3+, ![]() ,消耗K2Cr2O7物质的量为0.15mol;又AB段有对应关系:消耗I-0.6mol,
,消耗K2Cr2O7物质的量为0.15mol;又AB段有对应关系:消耗I-0.6mol,![]() ,消耗K2Cr2O7物质的量为0.1mol;共消耗K2Cr2O7物质的量为0.15+0.1=0.25mol,故B正确;
,消耗K2Cr2O7物质的量为0.1mol;共消耗K2Cr2O7物质的量为0.15+0.1=0.25mol,故B正确;
C.由分析知,在BC段发生反应:2Fe3++2I-=2Fe2++I2,故C正确;
D.根据计算可知,在反应前,K2Cr2O7物质的量为0.25mol, FeSO4与Fe3+一样都是0.9mol,二者之比不为1:6,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】25℃时,体积均为25.00mL,浓度均为0.0100mol/L的HA、H3B溶液分别用0.0100mol/LNaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法中正确的是( )
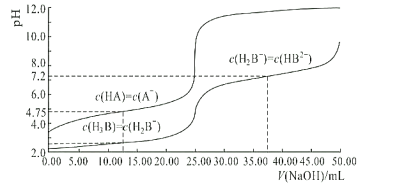
A.NaOH溶液滴定HA溶液可选甲基橙作指示剂
B.均为0.0100mol/LHA、H3B溶液中,酸性较强的是HA
C.25℃时,0.0100mol/LNa2HB溶液的pH>7
D.25℃时,H2B-离子的水解常数的数量级为10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE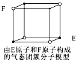
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
B.向ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀
C.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
D.溶解度小的沉淀不能转化为溶解度大的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率= ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
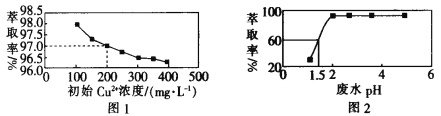
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式是________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是___________(填字母)。
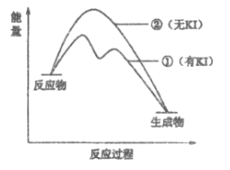
a. 加入KI后改变了反应的路径
b. 加入KI后改变了总反应的能量变化
c. H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)![]() I3-(aq) K=640。
I3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I- | I2 | I3- |
浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.天然弱碱水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.生活中用电解食盐水的方法制取消毒液,运用了盐类水解的原理
C.向CuCl2溶液中加入CaCO3,调节pH可除去溶液中混有的Fe3+
D.焊接时用NH4Cl溶液除锈与盐类水解有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A a g完全燃烧后通过足量的Na2O2,固体质量增重也是a g,则有机物可能是
①H2 ②CO ③CH3OH ④HCHO ⑤CH3COOCH3 ⑥C6H12O6 ⑦CH3CH2OH ⑧CH3CH2CH3 ⑨![]() ⑩
⑩![]()
A.①②B.⑤⑦⑧
C.④⑤⑨⑩D.③④⑥⑩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com