
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式是________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是___________(填字母)。
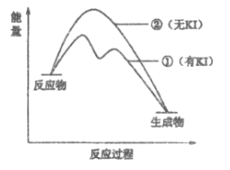
a. 加入KI后改变了反应的路径
b. 加入KI后改变了总反应的能量变化
c. H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)![]() I3-(aq) K=640。
I3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I- | I2 | I3- |
浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。
【答案】2H2O2![]() 2H2O+O2↑ a 下层溶液呈紫红色 在水溶液中I2的浓度降低 A试管中产生气泡明显变少;B试管中产生气泡速率没有明显减小
2H2O+O2↑ a 下层溶液呈紫红色 在水溶液中I2的浓度降低 A试管中产生气泡明显变少;B试管中产生气泡速率没有明显减小 ![]() 2c(I2)+c(I-)+3c(I3-)<0.033mol·L-1
2c(I2)+c(I-)+3c(I3-)<0.033mol·L-1
【解析】
(1)H2O2+I-=H2O+IO-,H2O2+IO-=H2O+O2↑+I-,把两式加和,即可得到总反应的化学方程式。
(2)a. 加入KI后,一步反应分为两步进行,也就是改变了反应的路径,a正确;
b. 加入KI后,反应物和生成物的能量都没有改变,b不正确;
c. 由图中可知,H2O2+I-=H2O+IO-是吸热反应,c不正确。
(3)①加CCl4并振荡、静置后还可观察到下层溶液呈紫红色,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. 在水溶液中I2的浓度降低。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是H2O2溶液的浓度相同,但产生气泡的速率差异很大。
(4)① ![]() ,由此可求出a。
,由此可求出a。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是原来溶液中c(I-)=![]() ,求出I-,I2,I3-中所含I的浓度和,二者比较便可得到结论。
,求出I-,I2,I3-中所含I的浓度和,二者比较便可得到结论。
(1)H2O2+I-=H2O+IO-,H2O2+IO-=H2O+O2↑+I-,把两式加和,即可得到总反应的化学方程式为2H2O2![]() 2H2O+O2↑。答案为:2H2O2
2H2O+O2↑。答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)a. 加入KI后,一步反应分为两步进行,也就是改变了反应的路径,a正确;
b. 加入KI后,反应物和生成物的能量都没有改变,b不正确;
c. 由图中可知,H2O2+I-=H2O+IO-的反应物总能量小于生成物总能量,所以该反应是吸热反应,c不正确。答案为:a;
(3)①加CCl4并振荡、静置后还可观察到下层溶液呈紫红色,说明有I2生成。答案为:下层溶液呈紫红色;
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. 在水溶液中I2的浓度降低。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是H2O2溶液的浓度相同,但产生气泡的速率差异很大。答案为:在水溶液中I2的浓度降低;A试管中产生气泡明显变少,B试管中产生气泡速率没有明显减小;
(4)① ![]() ,由此可求出a=2.5×10-3mol/L。答案为:2.5×10-3;
,由此可求出a=2.5×10-3mol/L。答案为:2.5×10-3;
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是原来溶液中,c(I-)=![]() ;现在溶液中,I-,I2,I3-中所含I的浓度和为2c(I2)+c(I-)+3c(I3-)=2×2.5×10-3+2.5×10-3+3×4.0×10-3=0.0195<0.033,I不守恒,说明产物中还有含碘微粒。答案为:2c(I2)+c(I-)+3c(I3-)<0.033mol·L-1。
;现在溶液中,I-,I2,I3-中所含I的浓度和为2c(I2)+c(I-)+3c(I3-)=2×2.5×10-3+2.5×10-3+3×4.0×10-3=0.0195<0.033,I不守恒,说明产物中还有含碘微粒。答案为:2c(I2)+c(I-)+3c(I3-)<0.033mol·L-1。


 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
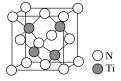
【题目】由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为__个,能量最高的电子占据的能级符号为___。
(2)磷的一种同素异形体—白磷(P4)的立体构型为__,推测其在CS2中的溶解度__(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:__。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:___。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为__,已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞边长为__cm(用含ρ、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,溴化银在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
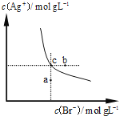
A.向溴化银悬浊液中加入溴化钠溶液,溴化银的Ksp减小
B.图中a点对应的是不饱和溶液
C.向c点对应的溶液中加入少量0.1 mol·L-1 AgNO3溶液,则c(Br-)增大
D.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性 K2Cr2O7 溶液可与 FeSO4 溶液反应生成 Fe3+和 Cr3+。现将硫酸酸化的 K2Cr2O7 溶液与 FeSO4 溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的 KI 的物质的量的变化关系如图所示,下列不正确的是
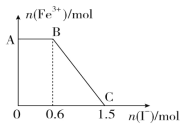
A.图中 AB 段的氧化剂为 K2Cr2O7
B.开始加入的 K2Cr2O7 为 0.25 mol
C.图中 BC 段发生的反应为 2Fe3++2I-=2Fe2++I2
D.混合之前,K2Cr2O7 与 FeSO4 的物质的量之比为 1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污
泥中Cr(Ⅲ)的处理工艺流程如下:
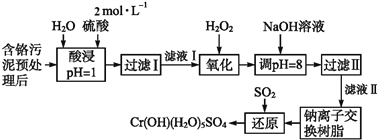
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸___mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________________________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:
___________________________________________。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为__________(填微粒的化学式)
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式______________________________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是____(选填编号),滴定终点现象是________________________。
A.NaCl B.K2CrO4 C.KI D.NaCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | 醋酸浓度的影响 | 0.5 | __ | 36.0 |
③ | __ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了_____________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了__(“氧化”或“还原”)反应,其电极反应式是___________________________________。
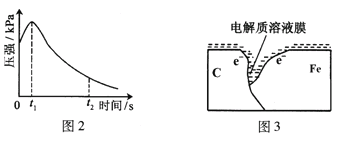
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:______________________________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
实验步骤和结论(不要求写具体操作过程):__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效开发利用CO2,已引起全世界的普遍重视。一定条件下,CO2可以转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
(1)在一恒温恒容密闭容器中充入1molCO2和3molH2进行上述反应。测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
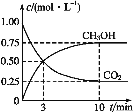
①0~10min内,氢气的平均反应速率为___,第10min后,保持温度不变,向该密闭容器中再充入1molCO2(g)和1molH2O(g),则平衡___(填“正向”“逆向”或“不”)移动。
②若已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(g) ΔH=-akJ·mol-1;
2H2(g)+ O2(g)=2H2O(g) ΔH=-bkJ·mol-1
H2O(g)=H2O(l) ΔH=-ckJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-dkJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程为___。
(2)如图所示,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解600mL一定浓度的NaCl溶液,电池的正极反应式为___。在电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为___mol。
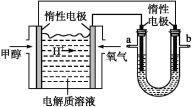
(3)向(2)电解后U形管的溶液中通入标准状况下89.6mL的CO2气体,则所得溶液呈___ (填“酸”“碱”或“中”)性,溶液中各离子浓度由大到小的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(OH-)
D.N点处的溶液中pH<12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com