
ЁОЬтФПЁП25ЁцЪБЃЌЬхЛ§ОљЮЊ25.00mLЃЌХЈЖШОљЮЊ0.0100mol/LЕФHAЁЂH3BШмвКЗжБ№гУ0.0100mol/LNaOHШмвКЕЮЖЈЃЌШмвКЕФpHЫцV(NaOH)БфЛЏЧњЯпШчЭМЫљЪОЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ
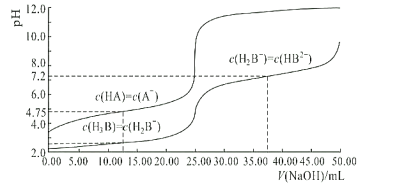
A.NaOHШмвКЕЮЖЈHAШмвКПЩбЁМзЛљГШзїжИЪОМС
B.ОљЮЊ0.0100mol/LHAЁЂH3BШмвКжаЃЌЫсадНЯЧПЕФЪЧHA
C.25ЁцЪБЃЌ0.0100mol/LNa2HBШмвКЕФpHЃО7
D.25ЁцЪБЃЌH2B-РызгЕФЫЎНтГЃЪ§ЕФЪ§СПМЖЮЊ10-3
ЁОД№АИЁПC
ЁОНтЮіЁП
AЃЎЕЮЖЈжеЕуЩњГЩЧПМюШѕЫсбЮЃЌШмвКГЪМюадЃЌЖјМзЛљГШЕФБфЩЋЗЖЮЇЪЧ3.1~4.4ЃЌЫљвдгІбЁЗгЬЊзїжИЪОМСЃЌЙЪAДэЮѓЃЛ
BЃЎгЩЭМПЩжЊЃЌХЈЖШОљЮЊ0.0100mol/LHAЁЂH3BШмвКжаЃЌHAЁЂH3BШмвКЃЌH3BШмвКЦ№ЪМЪБpHИќаЁЃЌЫЕУїH3BЕчРыГіЧтРызгЕФФмСІЧПгкHAЃЌдђЫсадНЯЧПЕФЮЊH3BЃЌЙЪBДэЮѓЃЛ
CЃЎ![]() ЃЌ
ЃЌ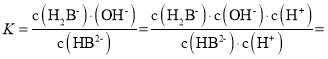
![]() ЃЌгЩЭМПЩжЊ
ЃЌгЩЭМПЩжЊ![]() ЪБЃЌpHЮЊ7.2ЃЌдђKa2=10-7.2ЃЌK=10-6.8ЃЌHB2-ЕФЕчРыГЃЪ§ЮЊKa3ЃЌгЩгкKa2>>Ka3ЃЌЫљвдГЃЮТЯТHB2-ЕФЫЎНтГЬЖШДѓгкЕчРыГЬЖШЃЌNaH2BШмвКГЪМюадЃЌЙЪCе§ШЗЃЛ
ЪБЃЌpHЮЊ7.2ЃЌдђKa2=10-7.2ЃЌK=10-6.8ЃЌHB2-ЕФЕчРыГЃЪ§ЮЊKa3ЃЌгЩгкKa2>>Ka3ЃЌЫљвдГЃЮТЯТHB2-ЕФЫЎНтГЬЖШДѓгкЕчРыГЬЖШЃЌNaH2BШмвКГЪМюадЃЌЙЪCе§ШЗЃЛ
DЃЎ![]() ЃЌK=
ЃЌK=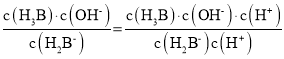
![]()
=![]() ЃЌгЩЭМПЩжЊЃЌ
ЃЌгЩЭМПЩжЊЃЌ![]() ЪБЃЌЧтРызгХЈЖШЕШгкKa1ЃЌвђДЫKa1ЕФСПМЖдк10-2~10-3ЃЌH2B-РызгЕФЫЎНтГЃЪ§ЕФЪ§СПМЖЮЊ10-12ЃЌЙЪDДэЮѓЁЃ
ЪБЃЌЧтРызгХЈЖШЕШгкKa1ЃЌвђДЫKa1ЕФСПМЖдк10-2~10-3ЃЌH2B-РызгЕФЫЎНтГЃЪ§ЕФЪ§СПМЖЮЊ10-12ЃЌЙЪDДэЮѓЁЃ
Д№АИбЁCЁЃ


 ИпжаБиЫЂЬтЯЕСаД№АИ
ИпжаБиЫЂЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкКИНгЭЦїЪБПЩгУNH4ClШмвКГ§ШЅЭЦїБэУцЕФбѕЛЏЭвдБуКИНгЃЌЦфЗДгІЮЊЃКCuOЃЋNH4Cl Ёњ CuЃЋCuCl2ЃЋN2ЁќЃЋH2O(ЮДХфЦН)ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ЗДгІжаБЛбѕЛЏКЭБЛЛЙдЕФдЊЫиЗжБ№ЮЊCuКЭN
B. ЗДгІжабѕЛЏМСКЭЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ3ЁУ2
C. ЗДгІжаВњЩњ0.2 molЦјЬхЪБЃЌзЊвЦ0.6 molЕчзг
D. ИУЗДгІжаБЛЛЙдЕФCuOеМВЮгыЗДгІCuOЕФ![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгЩNЁЂPЁЂTiЕШдЊЫизщГЩЕФаТаЭВФСЯгазХЙуЗКЕФгУЭОЃЌЧыЛиД№ЯТСаЮЪЬтЁЃ
ЃЈ1ЃЉюбдЊЫиЛљЬЌдзгЮДГЩЖдЕчзгЪ§ЮЊ__ИіЃЌФмСПзюИпЕФЕчзгеМОнЕФФмМЖЗћКХЮЊ___ЁЃ
ЃЈ2ЃЉСзЕФвЛжжЭЌЫивьаЮЬхЁЊАзСз(P4)ЕФСЂЬхЙЙаЭЮЊ__ЃЌЭЦВтЦфдкCS2жаЕФШмНтЖШ__(ЬюЁАДѓгкЁБЛђЁАаЁгкЁБ)дкЫЎжаЕФШмНтЖШЁЃ
ЃЈ3ЃЉСНжжШ§НЧзЖаЮЦјЬЌЧтЛЏЮяьЂ(PH3)КЭАБ(NH3)ЕФМќНЧЗжБ№ЮЊ93.6ЁуКЭ107ЁуЃЌЪдЗжЮіPH3ЕФМќНЧаЁгкNH3ЕФдвђЃК__ЁЃ
ЃЈ4ЃЉЙЄвЕЩЯжЦН№ЪєюбВЩгУН№ЪєЛЙдЫФТШЛЏюбЁЃЯШНЋTiO2(ЛђЬьШЛЕФН№КьЪЏ)КЭзуСПЬПЗлЛьКЯМгШШжС1000ЁЋ1100KЃЌНјааТШЛЏДІРэЃЌЩњГЩTiCl4ЁЃаДГіЩњГЩTiCl4ЕФЛЏбЇЗДгІЗНГЬЪНЃК___ЁЃ
ЃЈ5ЃЉгавЛжжЕЊЛЏюбОЇЬхЕФОЇАћШчЭМЫљЪОЃЌИУОЇЬхЕФЛЏбЇЪНЮЊ__ЃЌвбжЊОЇЬхЕФУмЖШЮЊІбgЁЄcm-3ЃЌАЂЗќМгЕТТоГЃЪ§ЮЊNAЃЌдђОЇАћБпГЄЮЊ__cm(гУКЌІбЁЂNAЕФЪНзгБэЪО)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌМИжжФбШмН№ЪєЧтбѕЛЏЮяЗжБ№дкШмвКжаДяЕНГСЕэШмНтЦНКтКѓЃЌИФБфШмвКЕФpHЃЌН№ЪєбєРызгХЈЖШЕФБфЛЏШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
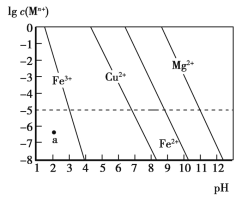
A.aЕуДњБэFe(OH)3ЕФБЅКЭШмвК
B.Ksp[Cu(OH)2]<Ksp[Fe(OH)2]
C.Яђ0.1 molЁЄL-1Cu2+ЁЂMg2+ЁЂFe2+ЛьКЯШмвКжаЃЌж№ЕЮЕЮМгЯЁNaOHШмвКЃЌMg2+зюЯШГСЕэ
D.дкpH=7ЕФШмвКжаЃЌCu2+ЁЂMg2+ЁЂFe2+ФмДѓСПЙВДц
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
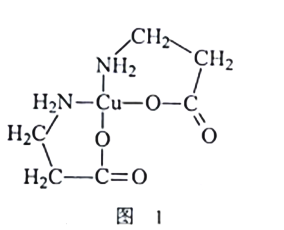
ЁОЬтФПЁПЛЦЭПѓ(жївЊГЩЗжЪЧCuFeS2)ЪЧвЛжжживЊЕФЛЏЙЄдСЯЃЌЭЈЙ§ЛЏбЇЙЄвеПЩЛёЕУЖў(АБЛљБћЫс)КЯЭ[Cu(NH2CH2CH2COO)2]ЕШВњЦЗЁЃ
ЃЈ1ЃЉCu2+ЛљЬЌКЫЭтЕчзгХХВМЪНЮЊ________
ЃЈ2ЃЉ[Cu(NH2CH2CH2COO)2]ЕФНсЙЙМђЪНШчЭМ1ЫљЪОЁЃ1mol[Cu(NH2CH2CH2COO)2]жаКЌгаІвМќЪ§ФПЮЊ_______ЃЛCЁЂNЁЂOШ§жждЊЫиЕФЕквЛЕчРыФмгЩаЁЕНДѓЕФЫГађЪЧ__________
ЃЈ3ЃЉЛЦЭПѓдкПеЦјжазЦЩеЕУЕНЗЯЦјКЭЙЬЬхЛьКЯЮяЁЃЗЯЦјжаSO2ОДпЛЏбѕЛЏЩњГЩSO3ЃЌSO2ЗжзгжаSдзгЙьЕРЕФдгЛЏРраЭЮЊ_____ЁЃSO3ЗжзгЕФПеМфЙЙаЭЮЊ______ЃЛЙЬЬхЛьКЯЮяжаКЌгавЛжжЛЏКЯЮяXЃЌЦфОЇАћШчЭМ2ЫљЪОЃЌЛЏКЯЮяXЕФЛЏбЇЪНЮЊ____________ЁЃ
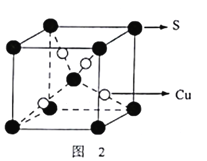 ЁЃ
ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжїзхдЊЫиWЁЂXЁЂYЁЂZЕФдзгађЪ§вРДЮдіМгЃЌЧвОљВЛГЌЙ§20ЁЃWЁЂXЁЂYзюЭтВуЕчзгЪ§жЎКЭЮЊ15ЃЌ![]() ЪЧЪЕбщЪвГЃгУЕФвЛжжЛЏбЇЪдМСЁЃЯТСаЫЕЗЈжаДэЮѓЕФЪЧЃЈ ЃЉ
ЪЧЪЕбщЪвГЃгУЕФвЛжжЛЏбЇЪдМСЁЃЯТСаЫЕЗЈжаДэЮѓЕФЪЧЃЈ ЃЉ
A.Z2YЕФЫЎШмвКГЪМюад
B.зюМђЕЅЧтЛЏЮяЗаЕуИпЕЭЮЊЃКXЃОW
C.ГЃМћЕЅжЪЕФбѕЛЏадЧПШѕЮЊЃКWЃОY
D.![]() жаИїдзгзюЭтВуОљТњзу8ЕчзгЮШЖЈНсЙЙ
жаИїдзгзюЭтВуОљТњзу8ЕчзгЮШЖЈНсЙЙ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
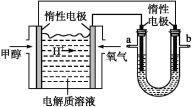
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌфхЛЏвјдкЫЎжаЕФГСЕэШмНтЦНКтЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
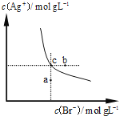
A.ЯђфхЛЏвјаќзЧвКжаМгШыфхЛЏФЦШмвКЃЌфхЛЏвјЕФKspМѕаЁ
B.ЭМжаaЕуЖдгІЕФЪЧВЛБЅКЭШмвК
C.ЯђcЕуЖдгІЕФШмвКжаМгШыЩйСП0.1 molЁЄLЃ1 AgNO3ШмвКЃЌдђc(BrЃ)діДѓ
D.дкAgBrБЅКЭШмвКжаМгШыNaBrЙЬЬхЃЌПЩЪЙШмвКгЩcЕуБфЕНbЕу
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЫсад K2Cr2O7 ШмвКПЩгы FeSO4 ШмвКЗДгІЩњГЩ Fe3ЃЋКЭ Cr3ЃЋЁЃЯжНЋСђЫсЫсЛЏЕФ K2Cr2O7 ШмвКгы FeSO4 ШмвКЛьКЯЃЌГфЗжЗДгІКѓдйЯђЫљЕУШмвКжаМгШыKIШмвКЃЌЛьКЯШмвКжаFe3ЃЋЕФЮяжЪЕФСПЫцМгШыЕФ KI ЕФЮяжЪЕФСПЕФБфЛЏЙиЯЕШчЭМЫљЪОЃЌЯТСаВЛе§ШЗЕФЪЧ
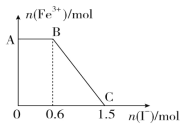
A.ЭМжа AB ЖЮЕФбѕЛЏМСЮЊ K2Cr2O7
B.ПЊЪММгШыЕФ K2Cr2O7 ЮЊ 0.25 mol
C.ЭМжа BC ЖЮЗЂЩњЕФЗДгІЮЊ 2Fe3+ЃЋ2IЃ=2Fe2+ЃЋI2
D.ЛьКЯжЎЧАЃЌK2Cr2O7 гы FeSO4 ЕФЮяжЪЕФСПжЎБШЮЊ 1:6
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАЕЭЬМбЛЗЁБв§Ц№ИїЙњЕФИпЖШжиЪгЃЌЖјШчКЮНЕЕЭДѓЦјжаCO2ЕФКЌСПМАгааЇПЊЗЂРћгУCO2ЃЌвбв§Ц№ШЋЪРНчЕФЦеБщжиЪгЁЃвЛЖЈЬѕМўЯТЃЌCO2ПЩвдзЊЛЏЮЊМзДМЃКCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ЁЃ
CH3OH(g)+H2O(g)ЁЃ
ЃЈ1ЃЉдквЛКуЮТКуШнУмБеШнЦїжаГфШы1molCO2КЭ3molH2НјааЩЯЪіЗДгІЁЃВтЕУCO2(g)КЭCH3OH(g)ХЈЖШЫцЪБМфБфЛЏШчЭМЫљЪОЁЃ
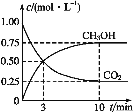
Ђй0ЁЋ10minФкЃЌЧтЦјЕФЦНОљЗДгІЫйТЪЮЊ___ЃЌЕк10minКѓЃЌБЃГжЮТЖШВЛБфЃЌЯђИУУмБеШнЦїжадйГфШы1molCO2(g)КЭ1molH2O(g)ЃЌдђЦНКт___(ЬюЁАе§ЯђЁБЁАФцЯђЁБЛђЁАВЛЁБ)вЦЖЏЁЃ
ЂкШєвбжЊЃКCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ІЄH=-akJЁЄmol-1ЃЛ
CH3OH(g)+H2O(g) ІЄH=-akJЁЄmol-1ЃЛ
2H2(g)+ O2(g)=2H2O(g) ІЄH=-bkJЁЄmol-1
H2O(g)=H2O(l) ІЄH=-ckJЁЄmol-1ЃЛ
CH3OH(g)=CH3OH(l) ІЄH=-dkJЁЄmol-1ЁЃ
дђБэЪОCH3OH(l)ШМЩеШШЕФШШЛЏбЇЗНГЬЮЊ___ЁЃ
ЃЈ2ЃЉШчЭМЫљЪОЃЌ25ЁцЪБвдМзДМШМСЯЕчГи(ЕчНтжЪШмвКЮЊЯЁСђЫс)ЮЊЕчдДЕчНт600mLвЛЖЈХЈЖШЕФNaClШмвКЃЌЕчГиЕФе§МЋЗДгІЪНЮЊ___ЁЃдкЕчНтвЛЖЮЪБМфКѓЃЌNaClШмвКЕФpHБфЮЊ12(МйЩшЕчНтЧАКѓNaClШмвКЕФЬхЛ§ВЛБф)ЃЌдђРэТлЩЯЯћКФМзДМЕФЮяжЪЕФСПЮЊ___molЁЃ
ЃЈ3ЃЉЯђЃЈ2ЃЉЕчНтКѓUаЮЙмЕФШмвКжаЭЈШыБъзМзДПіЯТ89.6mLЕФCO2ЦјЬхЃЌдђЫљЕУШмвКГЪ___ (ЬюЁАЫсЁБЁАМюЁБЛђЁАжаЁБ)адЃЌШмвКжаИїРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com