
【题目】软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为MnO2+SO2=MnSO4。已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、A13+(使其浓度均小于1×10-6 mol·L-1),需调节溶液pH范围为__________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) △H=-159.5kJ·mol-1
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) △H=+116.5kJ·mol-1
③H2O(1)===H2O(g) △H=+44kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为___________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:

①根据如图判断该反应的△H___________0(填“>”“<”或“=”),理由是___________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO)2=___________,反应的平衡常数K=______(保留三位小数)
③该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有______(填编号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH___________(填“增大”“减小”或“不变”),负极的电极反应式为___________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为___________;常温下将 a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈___________(填“酸”“碱”或“中”)性,溶液中c(HN3)=___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.可直接根据Ksp的数值大小比较难溶物在水中的溶解度
B.AgCl易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl)
C.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE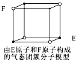
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A. 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B. 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C. 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D. 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率= ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
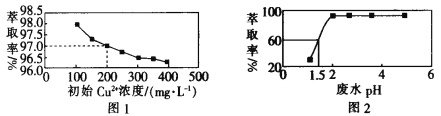
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
(1)基态 Ni 原子中,电子填充的能量最高的能级符号为_________,价层电子的轨道表达式为_________。
(2)Ni的两种配合物结构如图所示:
A B
①A 的熔、沸点高于B的原因为_________。
②A晶体含有化学键的类型为___________(填选项字母)。
A.σ键 B.π键 C.配位键 D.金属键
③A晶体中N原子的杂化形式是_________。
(3) 人工合成的砷化镍常存在各种缺陷,某缺陷砷化镍的组成为Ni1.2As, 其中 Ni 元素只有+2 和+3 两种价态, 两种价态的镍离子数目之比为_________。
(4) NiAs的晶胞结构如图所示:

①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的砷离子之间的距离为_________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
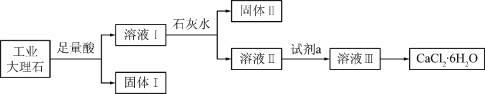
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com