
【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
【答案】AC
【解析】
先分析反应:CO(g)+2H2(g) ![]() CH3OH(g),气体分子数两边不等;再对比容器Ⅰ、Ⅱ,体积相等,均从反应物开始,Ⅱ中H2浓度是Ⅰ中H2的一半,平衡后Ⅱ中H2浓度也是Ⅰ中H2的一半,如果a=1, 则Ⅰ相当于在与Ⅱ等效的基础上加压,平衡偏向正向,平衡时H2的物质的量浓度小于1molL-1,所以a应小于1。根据Ⅱ的平衡可计算出T1时的平衡常数:
CH3OH(g),气体分子数两边不等;再对比容器Ⅰ、Ⅱ,体积相等,均从反应物开始,Ⅱ中H2浓度是Ⅰ中H2的一半,平衡后Ⅱ中H2浓度也是Ⅰ中H2的一半,如果a=1, 则Ⅰ相当于在与Ⅱ等效的基础上加压,平衡偏向正向,平衡时H2的物质的量浓度小于1molL-1,所以a应小于1。根据Ⅱ的平衡可计算出T1时的平衡常数:
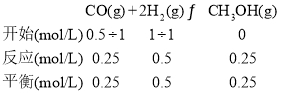
![]()
可在此基础上对各选项作出判断。
A. 0~5 min时,容器Ⅰ中v(CO)=![]() v(H2)=
v(H2)= ![]() ×
×![]() =0.1 mol·L-1·min-1,A选项正确;
=0.1 mol·L-1·min-1,A选项正确;
B. 如果a=1,则Ⅰ相当于在与Ⅱ等效的基础上加压,使得平衡时H2的物质的量浓度小于1molL-1,B选项错误;
C. 容器Ⅱ温度改变为T2(T2>T1)时,平衡常数KT2=1<KT1=4,说明升高温度反应逆向移动,则ΔH<0,C选项正确;
D. T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,此时Q=![]() =1<KT1=4,反应将向正反应方向进行,D选项错误;
=1<KT1=4,反应将向正反应方向进行,D选项错误;
答案选AC。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5。下列说法不正确的是
A.浓度均为0.1mol·L-1的HCOONa和CH3COONa溶液中离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积:前者小于后者
C.0.2mol·L-1 HCOOH与0.1mol·L-1 NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D.0.2mol·L-1 CH3COONa 与 0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl- )>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
【沉淀制备】取一定量胆矾(CuSO4·5H2O)溶于水,再滴几滴稀硫酸,充分搅拌后得到一定体积的CuSO4溶液。向其中加适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是________。
(2)用无水乙醇洗涤的目的是________。
【实验探究】同学们设计了如下装置,用制得的蓝绿色固体进行实验:
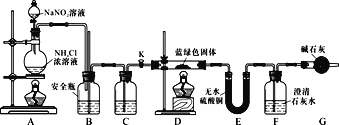
(3)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生的N2将装置中的空气排除,避免干扰。C中盛装的试剂应是________。
(4)装置A中发生反应的离子方程式为________。
(5)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是________。
(6)同学们查阅文献知:Ksp(CaCO3)=2.8×10-9,Ksp(BaCO3)=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是________。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是________。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“锂—呼吸CO2电化学装置”放电时的原理如下图所示,下列说法正确的是
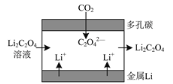
A.金属Li电极发生还原反应
B.多孔碳电极的电极反应式为:2CO2+2e-=C2O42-
C.每生成0.1 mol Li2C2O4,电路中有0.1 mol e-发生转移
D.电池“吸入”CO2时将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参醇是一种中药成分,结构简式如图所示。下列关于丹参醇的描述正确的是

A.能与浓硫酸共热后发生消去反应
B.能与NaHCO3溶液反应放出气体
C.分子中含有2个手性碳原子
D.1 mol丹参醇最多能与5 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加___溶液,溶液颜色无明显变化,由此可知样品中无Fe3+。
(2)为测定绿矾中结晶水含量,称石英玻璃管(带开关K1和K2)(设为装置A)的质量,记为m1g。将样品装入石英玻璃管中,再次称其质量,记为m2g。按如图连接好装置进行实验。

①仪器B的名称是___。
②将下列实验操作步骤正确排序___(填字母);重复上述操作步骤,直至A质量不变,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式,结晶水数目x=___。若实验时按a、d次序操作,则使x___(填偏大偏小或无影响)。
(3)为探究硫酸亚铁的分解产物,将(2)中已质量不变的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
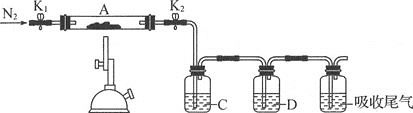
①C、D中的溶液依次为___(填字母),可观察到C、D中有气泡冒出。
a.品红 b.NaOH C.BaCl2 d.Ba(NO3 )2 e.浓硫酸
②写出硫酸亚铁高温分解反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn(H2PO4)2·2H2O是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备Mn(H2PO4)2·2H2O的流程如图:
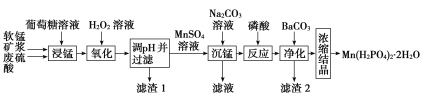
(1)软锰矿要先制成矿浆的目的是__,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为:__。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表,“调pH并过滤”时,应调整的pH范围为__,滤渣1的主要成分为__(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为__。
(5)某工厂用上述流程制备Mn(H2PO4)2·2H2O,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1吨该软锰矿可制得Mn(H2PO4)2·2H2O__t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为MnO2+SO2=MnSO4。已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、A13+(使其浓度均小于1×10-6 mol·L-1),需调节溶液pH范围为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com