
【题目】常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5。下列说法不正确的是
A.浓度均为0.1mol·L-1的HCOONa和CH3COONa溶液中离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积:前者小于后者
C.0.2mol·L-1 HCOOH与0.1mol·L-1 NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D.0.2mol·L-1 CH3COONa 与 0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl- )>c(CH3COOH)>c(H+)
【答案】C
【解析】
A.根据题目信息可知Ka(HCOOH) >Ka(CH3COOH),即HCOOH电离程度大于CH3COOH,则HCOO-的水解程度小于CH3COO-的水解程度,所以在CH3COONa溶液中有更多的醋酸根发生水解,故A正确;
B.电离平衡常数越大,酸的酸性越强,根据题目信息可知,酸性:HCOOH>CH3COOH,则pH相同的HCOOH、CH3COOH,酸浓度c(CH3COOH)>c(HCOOH),相同体积相同pH值的HCOOH和CH3COOH,n(CH3COOH)>n(HCOOH),分别与相同浓度的NaOH中和,消耗NaOH体积与酸的物质的量成正比,所以消耗NaOH体积:HCOOH<CH3COOH,故B正确;
C.混合溶液中溶质为等物质的量浓度的HCOOH、HCOONa,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(HCOO-)+c(OH-)=c(Na+)+c(H+)、物料守恒得c(HCOO-)+c(HCOOH)=2c(Na+),所以得c(HCOO-)+2c(OH-)=c(HCOOH)+2c(H+),故C错误;
D.混合溶液中溶质为等物质的量浓度的CH3COONa、CH3COOH、NaCl,醋酸水解平衡常数Kh=![]() ≈5.1×10-10<Ka,所以该溶液中CH3COONa水解程度小于CH3COOH电离程度,溶液呈酸性,但是醋酸电离程度较小,所以存在c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故D正确;
≈5.1×10-10<Ka,所以该溶液中CH3COONa水解程度小于CH3COOH电离程度,溶液呈酸性,但是醋酸电离程度较小,所以存在c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故D正确;
故答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,为检验其成分,某研究性学习小组做了如下实验,请根据所做实验,按要求填空。
(1)取少量新制氯水于试管中,加入碳酸钙粉末,发现有气泡产生,则说明起作用
的成分是HCl,HCl表现出 性。
(2)取少量新制氯水于试管中,加入AgNO3溶液,发现有白色沉淀产生,则起作用的是 。
(3)取少量新制氯水于试管中,加入一块红纸,发现很快褪色,则起作用的是 。
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有 性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(+6价)废水严重危害人体健康,工业上常用还原法进行处理。其部分工艺流程如下:
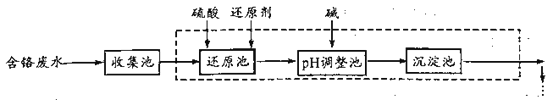
(1)废水中,六价铬以CrO42-;或者Cr2O72-的形式存在,写出其相互转化的离子方程式______。我国常用NaHSO3做还原剂,写出还原池中反应的离子方程式__________。
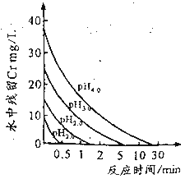
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pH=2.5~3.0,原因可能是_____________。
(3)沉淀池中生成Cr(OH)3的颗粒太细,为促使其更好地沉淀,可采取的措施是________。
(4)我国规定,工业废水中含Cr(VI)量的排放标准为0.1 mg/L。已知:Cr的相对原子质量为52,Kap(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO42-,达到废水排放标准时,废水中Ba2+浓度最低为___________mol/L(保留小数点后2位)。用Ba2+除去废水中的CrO42-是否可行,为什么?请简要回答。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C是广泛存在于新鲜水果蔬菜及许多生物中的一种重要的维生素,作为一种高活性物质,它参与许多新陈代谢过程。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
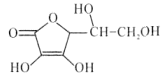 +I2
+I2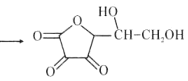 +2HI
+2HI
下列说法正确的是( )
A.上述反应说明维生素C能使碘水褪色,该反应的反应类型为取代反应
B.维生素C可发生取代反应、加成反应、氧化反应
C.维生素C可以水解得到2种产物
D.维生素C不可溶于水,可以溶于有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用沉淀滴定法快速测定待测溶液中c(Cl-)。
滴定的主要步骤:
a.取待测溶液25.00mL于锥形瓶中。
b.加入25.00mL 0.1000mol·L-1 AgNO3溶液(过量),使Cl-完全转化为AgCl沉淀。
c.加入少量硝基苯并振荡,使其覆盖沉淀,避免沉淀与溶液接触。
d.加入NH4Fe(SO4)2溶液作指示剂。
e.用0.1000mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀。
f.重复上述操作两次。
三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
g.数据处理。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
(1)滴定终点的现象为______________________________。
(2)步骤c中加入硝基苯的目的是______________________________。
(3)计算待测溶液中c(Cl-)=__________mol·L-1。
(4)判断下列操作对c(Cl-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果__________;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)Al2(SO4)3溶液显酸性的离子方程式:____________________________;
(2)CuSO4溶液与过量氨水反应的离子方程式:____________________________;
(3)Mg-Al-NaOH溶液组成的原电池,负极的电极反应式:_________________________;
(4)CH3OH-O2燃料电池,KOH溶液作电解质,负极的电极反应式:____________________;
(5)惰性电极电解CuSO4溶液的总反应的化学方程式:______________________________;
(6)Na2C2O4溶液的物料守恒:______________________________;
(7)Fe3+的基态电子排布式:______________________________;
(8)N2H4的结构式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L1的盐酸滴定20 mL约0.1 mol·L1氨水,滴定曲线如图所示,下列说法正确的是
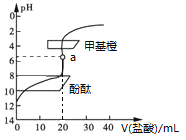
A. a点溶液中:c(H+)=c(OH)+c(NH3·H2O)
B. 滴定过程中,当溶液的pH=7时,两者恰好中和
C. 用酚酞作指示剂比用甲基橙作指示剂,滴定误差更小
D. 当滴入盐酸为30 mL时,溶液中:c(NH4+)+c(H+)<c(OH)+c(Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com