
【题目】用沉淀滴定法快速测定待测溶液中c(Cl-)。
滴定的主要步骤:
a.取待测溶液25.00mL于锥形瓶中。
b.加入25.00mL 0.1000mol·L-1 AgNO3溶液(过量),使Cl-完全转化为AgCl沉淀。
c.加入少量硝基苯并振荡,使其覆盖沉淀,避免沉淀与溶液接触。
d.加入NH4Fe(SO4)2溶液作指示剂。
e.用0.1000mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀。
f.重复上述操作两次。
三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
g.数据处理。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
(1)滴定终点的现象为______________________________。
(2)步骤c中加入硝基苯的目的是______________________________。
(3)计算待测溶液中c(Cl-)=__________mol·L-1。
(4)判断下列操作对c(Cl-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果__________;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则测定结果__________。
【答案】溶液变红,且半分钟不褪色 防止AgCl沉淀转化为AgSCN沉淀 0.06 偏高 偏低
【解析】
该滴定方法的原理是,利用已知浓度和体积的硝酸银溶液与氯离子反应,然后通过已知浓度的NH4SCN溶液滴定过量的Ag+,从而求出与Ag+反应的Cl-的物质的量,滴定过程中存在数量关系n(Cl-)~n沉淀(Ag+)~[n总(Ag+)-n(NH4SCN)];NH4Fe(SO4)2溶液作指示剂,当Ag+反应完全后,Fe3+会与SCN-反应使溶液变成血红色,加入少量硝基苯可以使生成的氯化银沉淀离开溶液,如果不加硝基苯,在水溶液中部分氯化银可以转化成AgSCN。
(1)NH4Fe(SO4)2溶液作指示剂,当Ag+反应完全后,Fe3+会与SCN-反应使溶液变成血红色,故滴定终点的现象为:溶液变红,且半分钟不褪色;
(2)加入少量硝基苯可以使生成的氯化银沉淀离开溶液,如果不加硝基苯,在水溶液中部分氯化银可以转化成AgSCN,故答案为:防止AgCl沉淀转化为AgSCN沉淀;
(3)滴定过程中存在数量关系n(Cl-)~n沉淀(Ag+)~[n总(Ag+)-n(NH4SCN)],滴定过程消耗的NH4SCN溶液体积为![]() (第一组数据偏差较大,故舍去),所以
(第一组数据偏差较大,故舍去),所以![]() =0.06mol/L,故答案为0.06mol/L;
=0.06mol/L,故答案为0.06mol/L;
(4)①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则会导致计算式中n总(Ag+)大于实际值,从而导致所测溶液浓度偏高;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则会导致计算式中n(NH4SCN)偏大,测定结果偏低;故答案为:偏高;偏低。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
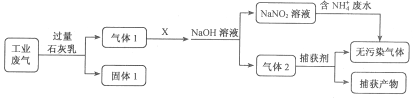
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,主要用于农药中间体以及有机磷水处理药剂的原料。常温下,向1L0.500mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示,下列说法正确的是
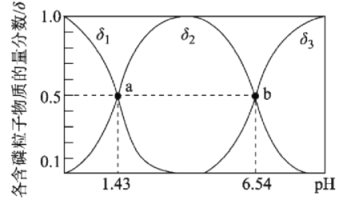
A.a、b两点时,水电离出的c水(OH-)之比为1.43:6.54
B.b点对应溶液中存在:c(Na+)=3c(HPO32-)
C.反应H3PO3+HPO32-![]() 2H2PO3-的平衡常数为105.11
2H2PO3-的平衡常数为105.11
D.当V(NaOH)=1 L 时,c(Na+)>c(H2PO3-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5。下列说法不正确的是
A.浓度均为0.1mol·L-1的HCOONa和CH3COONa溶液中离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积:前者小于后者
C.0.2mol·L-1 HCOOH与0.1mol·L-1 NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D.0.2mol·L-1 CH3COONa 与 0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl- )>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知25℃,H2C2O4的K1=5.0×10-2,K2=5.0×10-5。则NaHC2O4溶液显__________(填“酸性”或“碱性”)。
(2)已知25℃,H2CO3的K1=4×10-7,K2=5×10-11。CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为__________(写离子符号);若所得溶液中c(HCO3-):c(CO32-)=2:1,则溶液pH=__________。
(3)25℃时,V1L pH=11的NaOH溶液与V2L pH=3的H2SO4溶液混合,所得溶液的pH=10,则V1:V2=__________(混合过程中溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 用FeS去除废水中的Hg2+:Hg2+ + S2- === HgS↓
C. AlCl3溶液与Na2S溶液混合生成沉淀::2 Al3++3S2-==Al2S3↓
D. NH4Cl溶于D2O中显酸性:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个容积均为2L的密闭容器中按不同方式投入反应物,发生反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
容器 | 容器类型 | 起始温度/℃ | 起始物质的量/mol | 平衡时H2物质的量/mol | |||
CO | H2O | CO2 | H2 | ||||
Ⅰ | 恒温容器 | 800 | 1.2 | 0.6 | 0 | 0 | 0.4 |
Ⅱ | 恒温容器 | 900 | 0.7 | 0.1 | 0.5 | 0.5 | |
Ⅲ | 绝热容器 | 800 | 0 | 0 | 1.2 | 0.8 | |
下列说法正确的是
A.容器Ⅰ中反应经10min建立平衡,0~10min内,平均反应速率v(CO)=0.04 mol·L-1·min-1
B.若向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1 mol,平衡将逆向移动
C.达到平衡时,容器Ⅱ中反应吸收的热量小于0.1a kJ
D.达平衡时,容器Ⅲ中n(CO)<0.48 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加___溶液,溶液颜色无明显变化,由此可知样品中无Fe3+。
(2)为测定绿矾中结晶水含量,称石英玻璃管(带开关K1和K2)(设为装置A)的质量,记为m1g。将样品装入石英玻璃管中,再次称其质量,记为m2g。按如图连接好装置进行实验。

①仪器B的名称是___。
②将下列实验操作步骤正确排序___(填字母);重复上述操作步骤,直至A质量不变,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式,结晶水数目x=___。若实验时按a、d次序操作,则使x___(填偏大偏小或无影响)。
(3)为探究硫酸亚铁的分解产物,将(2)中已质量不变的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
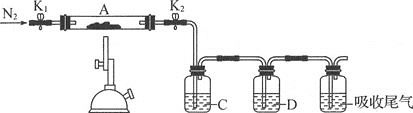
①C、D中的溶液依次为___(填字母),可观察到C、D中有气泡冒出。
a.品红 b.NaOH C.BaCl2 d.Ba(NO3 )2 e.浓硫酸
②写出硫酸亚铁高温分解反应的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com