
【题目】在三个容积均为2L的密闭容器中按不同方式投入反应物,发生反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
容器 | 容器类型 | 起始温度/℃ | 起始物质的量/mol | 平衡时H2物质的量/mol | |||
CO | H2O | CO2 | H2 | ||||
Ⅰ | 恒温容器 | 800 | 1.2 | 0.6 | 0 | 0 | 0.4 |
Ⅱ | 恒温容器 | 900 | 0.7 | 0.1 | 0.5 | 0.5 | |
Ⅲ | 绝热容器 | 800 | 0 | 0 | 1.2 | 0.8 | |
下列说法正确的是
A.容器Ⅰ中反应经10min建立平衡,0~10min内,平均反应速率v(CO)=0.04 mol·L-1·min-1
B.若向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1 mol,平衡将逆向移动
C.达到平衡时,容器Ⅱ中反应吸收的热量小于0.1a kJ
D.达平衡时,容器Ⅲ中n(CO)<0.48 mol
【答案】D
【解析】
A. 容器Ⅰ中反应经10min建立平衡,0~10min内,氢气改变量为0.4mol,CO改变量也为0.4mol,则平均反应速率![]() ,故A错误;
,故A错误;
B. 根据A选项,容器Ⅰ平衡体系中CO物质的量为0.8mol,H2O物质的量为0.2mol,CO2物质的量为0.4mol,H2物质的量为0.4mol,平衡常数为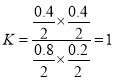 ,再向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1 mol,浓度商为
,再向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1 mol,浓度商为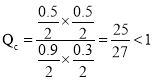 ,平衡正向移动,故B错误;
,平衡正向移动,故B错误;
C. 如果容器Ⅱ温度为800℃,达到平衡时,反应向左移动,生成0.1molCO,吸收0.1akJ能量,由于容器Ⅱ中温度为900℃,因此还要向左反应,生成的CO多余0.1mol,因此反应吸收的热量大于0.1a kJ,故C错误;
D. 假设是恒温容器,达平衡时,设转化生成CO物质的量为xmol,根据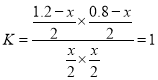 ,得到x=0.48mol,由于是绝热,反应向左,容器内温度降低,反应正向移动,因此容器Ⅲ中n(CO) < 0.48 mol,故D正确。
,得到x=0.48mol,由于是绝热,反应向左,容器内温度降低,反应正向移动,因此容器Ⅲ中n(CO) < 0.48 mol,故D正确。
综上所述,答案为D。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】化合物G是重要的药物中间体,合成路线如下:

回答下列问题:
(1)A的分子式为_________。
(2)B中含氧官能团的名称为_________。
(3)D→E的反应类型为_________。
(4)已知B与(CH3CO)2O的反应比例为1:2,B→C的反应方程式为_________。
(5)路线中②④的目的是_________。
(6)满足下列条件的B的同分异构体有_________种(不考虑立体异构)。
①苯环上只有2个取代基
②能与FeCl3溶液发生显色反应且能发生银镜反应
写出其中核磁共振氢谱为五组峰的物质的结构简式为_________。
(7)参考上述合成线路,写出以1-溴丁烷、丙二酸二乙酯、尿素[CO(NH2)2]为起始原料制备 的合成线路(其它试剂任选)_________。
的合成线路(其它试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用沉淀滴定法快速测定待测溶液中c(Cl-)。
滴定的主要步骤:
a.取待测溶液25.00mL于锥形瓶中。
b.加入25.00mL 0.1000mol·L-1 AgNO3溶液(过量),使Cl-完全转化为AgCl沉淀。
c.加入少量硝基苯并振荡,使其覆盖沉淀,避免沉淀与溶液接触。
d.加入NH4Fe(SO4)2溶液作指示剂。
e.用0.1000mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀。
f.重复上述操作两次。
三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
g.数据处理。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
(1)滴定终点的现象为______________________________。
(2)步骤c中加入硝基苯的目的是______________________________。
(3)计算待测溶液中c(Cl-)=__________mol·L-1。
(4)判断下列操作对c(Cl-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果__________;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是一种可溶于水的白色或淡黄色小晶体,食品级焦亚硫酸钠可作为贮存水果的保鲜剂等。某化学研究兴趣小组欲自制焦亚硫酸钠并探究其部分化学性质等。
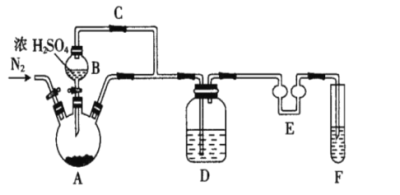
(1)制备Na2S2O5,如图(夹持及加热装置略)
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)
焦亚硫酸钠的析出原理:NaHSO3(饱和溶液)→Na2S2O5(晶体)+H2O(l)
①F中盛装的试剂是__,作用是__。
②通入N2的作用是__。
③Na2S2O5晶体在__(填“A”或“D”或“F”)中得到,再经离心分离,干燥后可得纯净的样品。
④若撤去E,则可能发生__。
(2)设计实验探究Na2S2O5的性质,完成表中填空:
预测Na2S2O5的性质 | 探究Na2S2O5性质的操作及现象 | |
探究一 | Na2S2O5的溶液呈酸性 | ① |
探究二 | Na2S2O5晶体具有还原性 | 取少量Na2S2O5晶体于试管中,滴加1mL2mol·L-1酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 |
①__。(提供:pH试纸、蒸馏水及实验必需的玻璃仪器)
②探究二中反应的离子方程式为__(KMnO4→Mn2+)
(3)利用碘量法可测定Na2S2O5样品中+4价硫的含量。
实验方案:将agNa2S2O5样品放入碘量瓶(带磨口塞的锥形瓶)中,加入过量c1mol·L-1的碘溶液,再加入适量的冰醋酸和蒸馏水,充分反应一段时间,加入淀粉溶液,__(填实验步骤),当溶液由蓝色恰好变成无色,且半分钟内溶液不恢复原色,则停止滴定操作重复以上步骤两次记录数据。(实验中必须使用的试剂有c2mol·L-1的标准Na2S2O3溶液;已知:2Na2S2O3+I2=Na2S4O6+2NaI)
(4)含铬废水中常含有六价铬[Cr(Ⅵ)]利用Na2S2O5和FeSO4·7H2O先后分两个阶段处理含Cr2O72-的废水,先将废水中Cr2O72-全部还原为Cr3+,将Cr3+全部转化为Cr(OH)3而除去,需调节溶液的pH范围为___。
{已知:Ksp[Cr(OH)3]=6.4×10-31,lg2≈0.3,c(Cr3+)<1.0×10-5mol·L-1时视为完全沉淀}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L1的盐酸滴定20 mL约0.1 mol·L1氨水,滴定曲线如图所示,下列说法正确的是
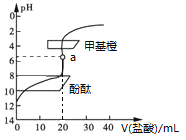
A. a点溶液中:c(H+)=c(OH)+c(NH3·H2O)
B. 滴定过程中,当溶液的pH=7时,两者恰好中和
C. 用酚酞作指示剂比用甲基橙作指示剂,滴定误差更小
D. 当滴入盐酸为30 mL时,溶液中:c(NH4+)+c(H+)<c(OH)+c(Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:

结合图像,写出CH4通过蒸汽转化为CO2和H2的热化学方程式______________________。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)
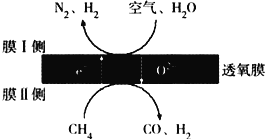
①起还原作用的物质是_________________________。
②膜I侧所得气体![]() =2,CH4、H2O、O2反应的化学方程式是______________________。
=2,CH4、H2O、O2反应的化学方程式是______________________。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________
2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________

A.Ⅰ、Ⅱ两过程到达平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程到达平衡时,NH3的体积分数:Ⅰ<Ⅱ
C.Ⅰ、Ⅱ两过程到达平衡的标志:混合气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器充入9.0molN2和23.0molH2,图为不同温度下平衡混合物中氨气的体积分数与总压强(P)的关系图。
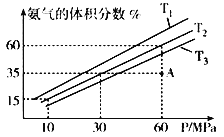
①T1、T2、T3由大到小的排序为______________________________。
②在T2、60MPa条件下,比较A点v正___v逆(填“>”、“<”或“=”),理由是____________。
③计算T2、60Mpa平衡体系的平衡常数Kp=__________。(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氧化铝基废催化剂(主要成分为![]() ,还含有少量Pd)回收
,还含有少量Pd)回收![]() 及Pd的流程如图:
及Pd的流程如图:
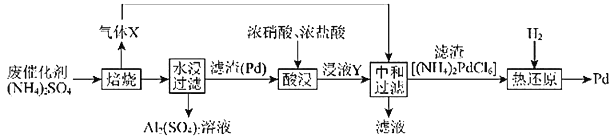
(1)![]() 溶液蒸干灼烧后所得物质的化学名称是_________。
溶液蒸干灼烧后所得物质的化学名称是_________。
(2)焙烧时![]() 与
与![]() 反应的化学方程式为__________。
反应的化学方程式为__________。
(3)浸液Y中含Pd元素的溶质是______(填化学式)。
(4)“热还原”中每生成![]() 生成的气体的物质的量为_________(已知热还原得到的固体只有Pd)。
生成的气体的物质的量为_________(已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为![]() ,其中x的最大值为0.8。已知:Pd的密度为
,其中x的最大值为0.8。已知:Pd的密度为![]() ,则
,则![]() 能储存标准状况下
能储存标准状况下![]() 的最大体积为________L(保留三位有效数字)。
的最大体积为________L(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图。其中A是一种酸式盐,E的相对分子质量比D的相对分子质量大16,当x为一种强酸时,有如下转化关系。下列说法不正确的是( )
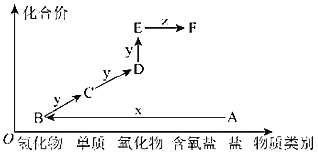
A.物质A、B、C、D、E、F中均含有硫元素
B.物质D可以使石蕊溶液先变红后褪色
C.物质C可在纯氧中燃烧,火焰呈蓝紫色
D.物质F的浓溶液可以用铁制容器盛放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对图中两极进行必要的连接并填空:
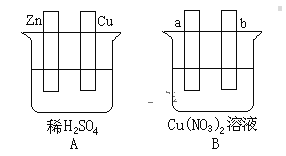
(1)在A图中,使铜片上冒H2气泡。请加以必要连接,则连接后的装置叫____。电极反应式:锌板:____;铜板:_____。
(2)在B图中,使a极析出铜,b极析出氧气。加以必要的连接后,该装置叫____。电极反应式,a极:____;b极:_____。经过一段时间后,停止反应,溶液的pH值____(升高、降低、不变),加入一定量的____后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com