
【题目】焦亚硫酸钠(Na2S2O5)是一种可溶于水的白色或淡黄色小晶体,食品级焦亚硫酸钠可作为贮存水果的保鲜剂等。某化学研究兴趣小组欲自制焦亚硫酸钠并探究其部分化学性质等。
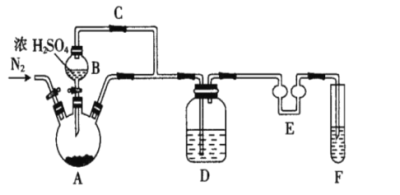
(1)制备Na2S2O5,如图(夹持及加热装置略)
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)
焦亚硫酸钠的析出原理:NaHSO3(饱和溶液)→Na2S2O5(晶体)+H2O(l)
①F中盛装的试剂是__,作用是__。
②通入N2的作用是__。
③Na2S2O5晶体在__(填“A”或“D”或“F”)中得到,再经离心分离,干燥后可得纯净的样品。
④若撤去E,则可能发生__。
(2)设计实验探究Na2S2O5的性质,完成表中填空:
预测Na2S2O5的性质 | 探究Na2S2O5性质的操作及现象 | |
探究一 | Na2S2O5的溶液呈酸性 | ① |
探究二 | Na2S2O5晶体具有还原性 | 取少量Na2S2O5晶体于试管中,滴加1mL2mol·L-1酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 |
①__。(提供:pH试纸、蒸馏水及实验必需的玻璃仪器)
②探究二中反应的离子方程式为__(KMnO4→Mn2+)
(3)利用碘量法可测定Na2S2O5样品中+4价硫的含量。
实验方案:将agNa2S2O5样品放入碘量瓶(带磨口塞的锥形瓶)中,加入过量c1mol·L-1的碘溶液,再加入适量的冰醋酸和蒸馏水,充分反应一段时间,加入淀粉溶液,__(填实验步骤),当溶液由蓝色恰好变成无色,且半分钟内溶液不恢复原色,则停止滴定操作重复以上步骤两次记录数据。(实验中必须使用的试剂有c2mol·L-1的标准Na2S2O3溶液;已知:2Na2S2O3+I2=Na2S4O6+2NaI)
(4)含铬废水中常含有六价铬[Cr(Ⅵ)]利用Na2S2O5和FeSO4·7H2O先后分两个阶段处理含Cr2O72-的废水,先将废水中Cr2O72-全部还原为Cr3+,将Cr3+全部转化为Cr(OH)3而除去,需调节溶液的pH范围为___。
{已知:Ksp[Cr(OH)3]=6.4×10-31,lg2≈0.3,c(Cr3+)<1.0×10-5mol·L-1时视为完全沉淀}
【答案】浓NaOH溶液 吸收剩余的SO2 排尽空气,防止Na2S2O5被氧化 D 倒吸 用适量蒸馏水溶解少量Na2S2O5固体于试管中,用玻璃棒醮取少量Na2S2O5溶液点在pH试纸上,试纸变红 5S2O52-+4MnO4-+2H+=10SO42-+4Mn2++H2O 用c2mol·L-1的标准Na2S2O3溶液滴定 pH>5.6
【解析】
从焦亚硫酸钠的析出原理[NaHSO3(饱和溶液)→Na2S2O5(晶体)+H2O(l)]可以看出,要制取Na2S2O5(晶体),需先制得NaHSO3(饱和溶液),所以A装置的作用是用浓硫酸与Na2SO3固体反应制取SO2,将SO2再通入饱和Na2SO3溶液中制得NaHSO3饱和溶液。因为Na2S2O5易被空气中的O2氧化,所以需排尽装置内的空气,这也就是在A装置内通入N2的理由。由于SO2会污染环境,所以F装置应为吸收尾气的装置,为防倒吸,加了装置E。
(1)①从以上分析知,F装置应为SO2的尾气处理装置,F中盛装的试剂是浓NaOH溶液,作用是吸收剩余的SO2。答案为:浓NaOH溶液;吸收剩余的SO2;
②为防装置内空气中的氧气将Na2S2O5、NaHSO3、Na2SO3等氧化,需排尽装置内的空气,所以通入N2的作用是排尽空气,防止Na2S2O5被氧化。答案为:排尽空气,防止Na2S2O5被氧化;
③Na2S2O5晶体由NaHSO3饱和溶液转化而得,所以应在D中得到。答案为:D;
④因为E中的双球能容纳较多液体,可有效防止倒吸,所以若撤去E,则可能发生倒吸。答案为:倒吸;
(2)①既然是检测其是否具有酸性,则需用pH试纸检测溶液的pH,若在酸性范围,则表明显酸性。具体操作为:用适量蒸馏水溶解少量Na2S2O5固体于试管中,用玻璃棒醮取少量Na2S2O5溶液点在pH试纸上,试纸变红。答案为:用适量蒸馏水溶解少量Na2S2O5固体于试管中,用玻璃棒醮取少量Na2S2O5溶液点在pH试纸上,试纸变红;
②探究二中,Na2S2O5具有还原性,能将KMnO4还原为Mn2+,自身被氧化成SO42-,同时看到溶液的紫色褪去,反应的离子方程式为5S2O52-+4MnO4-+2H+=10SO42-+4Mn2++H2O。答案为:5S2O52-+4MnO4-+2H+=10SO42-+4Mn2++H2O;
(3)根据信息,滴定过量碘的操作是:用c2mol·L-1的标准Na2S2O3溶液滴定。答案为:用c2mol·L-1的标准Na2S2O3溶液滴定;
(4)c(Cr3+)<1.0×10-5mol·L-1时,Ksp[Cr(OH)3]=6.4×10-31,即1.0×10-5×c3(OH-)>6.4×10-31,c(OH-)>4.0×10-9mol·L-1,c(H+)<![]() =
=![]() mol·L-1,pH>5+2lg2=5.6。
mol·L-1,pH>5+2lg2=5.6。
答案为:pH>5.6。


科目:高中化学 来源: 题型:
【题目】德国化学家哈伯在合成氨方面的研究促进了人类的发展。合成氨的工业流程如图,下列说法错误的是
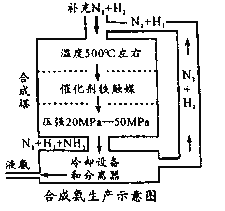
A.增大压强既可以加快反应速率,又可以提高原料转化率
B.升高温度可提高平衡转化率
C.冷却过程中采用热交换有助于节约能源
D.原料循环可提高其利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,主要用于农药中间体以及有机磷水处理药剂的原料。常温下,向1L0.500mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示,下列说法正确的是
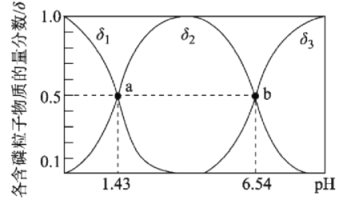
A.a、b两点时,水电离出的c水(OH-)之比为1.43:6.54
B.b点对应溶液中存在:c(Na+)=3c(HPO32-)
C.反应H3PO3+HPO32-![]() 2H2PO3-的平衡常数为105.11
2H2PO3-的平衡常数为105.11
D.当V(NaOH)=1 L 时,c(Na+)>c(H2PO3-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知25℃,H2C2O4的K1=5.0×10-2,K2=5.0×10-5。则NaHC2O4溶液显__________(填“酸性”或“碱性”)。
(2)已知25℃,H2CO3的K1=4×10-7,K2=5×10-11。CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为__________(写离子符号);若所得溶液中c(HCO3-):c(CO32-)=2:1,则溶液pH=__________。
(3)25℃时,V1L pH=11的NaOH溶液与V2L pH=3的H2SO4溶液混合,所得溶液的pH=10,则V1:V2=__________(混合过程中溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 用FeS去除废水中的Hg2+:Hg2+ + S2- === HgS↓
C. AlCl3溶液与Na2S溶液混合生成沉淀::2 Al3++3S2-==Al2S3↓
D. NH4Cl溶于D2O中显酸性:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是
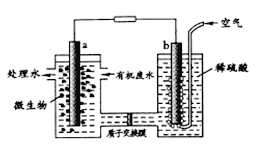
A. a 电极发生反应:H2NCH2CH2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
B. 质子交换膜处H+由右向左移动
C. 该电池在微生物作用下将化学能转化为电能
D. 开始放电时b极附近pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个容积均为2L的密闭容器中按不同方式投入反应物,发生反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
容器 | 容器类型 | 起始温度/℃ | 起始物质的量/mol | 平衡时H2物质的量/mol | |||
CO | H2O | CO2 | H2 | ||||
Ⅰ | 恒温容器 | 800 | 1.2 | 0.6 | 0 | 0 | 0.4 |
Ⅱ | 恒温容器 | 900 | 0.7 | 0.1 | 0.5 | 0.5 | |
Ⅲ | 绝热容器 | 800 | 0 | 0 | 1.2 | 0.8 | |
下列说法正确的是
A.容器Ⅰ中反应经10min建立平衡,0~10min内,平均反应速率v(CO)=0.04 mol·L-1·min-1
B.若向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1 mol,平衡将逆向移动
C.达到平衡时,容器Ⅱ中反应吸收的热量小于0.1a kJ
D.达平衡时,容器Ⅲ中n(CO)<0.48 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.由反应![]() ,可知
,可知![]() 是碱性氧化物
是碱性氧化物
B.![]() 通入品红溶液,溶液褪色的原理与
通入品红溶液,溶液褪色的原理与![]() 通入溴水后褪色的原理相同
通入溴水后褪色的原理相同
C.由反应![]() ,可知生成
,可知生成![]() 能降低
能降低![]() 的浓度
的浓度
D.由常温下金属钠、铝可溶于NaOH溶液,可知金属镁也能溶于NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构为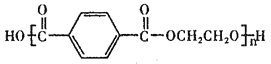 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:
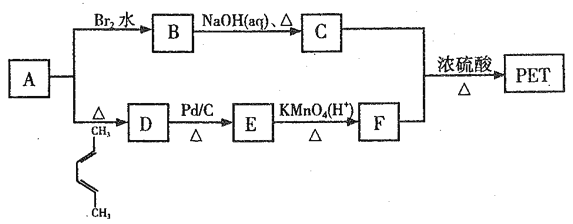
已知:①![]() ;②
;②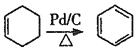 。
。
根据题意回答下列问题:
(1)A的名称是_______,C所含官能团的名称是_______。
(2)由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚l,3-丁二烯的结构简式_______。
(3)A→D、B→C的反应类型分别为_______ 、_______。
(4)写出C+F→PET的化学反应方程式______________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有_____种。
(6)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶(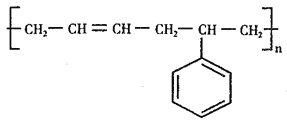 )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com