
【题目】Mn(H2PO4)2·2H2O是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备Mn(H2PO4)2·2H2O的流程如图:
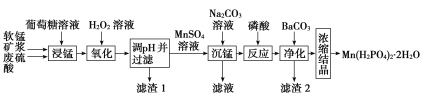
(1)软锰矿要先制成矿浆的目的是__,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为:__。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表,“调pH并过滤”时,应调整的pH范围为__,滤渣1的主要成分为__(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为__。
(5)某工厂用上述流程制备Mn(H2PO4)2·2H2O,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1吨该软锰矿可制得Mn(H2PO4)2·2H2O__t。
【答案】增大反应物接触面积,加快反应速率,提高原料利用率 12:1 2Fe2++H2O2+2H+=2Fe3++2H2O 5.0~7.8 Fe(OH)3和Al(OH)3 MnCO3+2H3PO4=Mn(H2PO4)2+CO2↑+H2O 2.59(或2.5935)
【解析】
(1)液态可以增大反应物接触面积,加快反应速率,提高原料利用率;根据化合价升降守恒,可算氧化剂与还原剂的物质的量之比;
(2)用H2O2溶液氧化溶液中的亚铁离子得2Fe3+;
(3)根据几种金属离子的氢氧化物开始沉淀和完全沉淀的pH进行分析;
(4)碳酸钠与硫酸锰反应生成碳酸锰,加入磷酸使碳酸锰生成Mn(H2PO4)2;
(5)根据质量守恒,可以算出答案。
(1)软锰矿要先制成矿浆,可以增大反应物接触面积,加快反应速率,提高原料利用率;葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,反应中MnO2中Mn的化合价由+4价变成+2价,是氧化剂,化合价变化2,葡萄糖是还原剂,其中C元素的化合价由0价变成+4价,化合价变化4×6=24,根据化合价升降守恒,氧化剂与还原剂的物质的量之比为12:1,故答案为:增大反应物接触面积,加快反应速率,提高原料利用率;12:1;
(2)用H2O2溶液氧化溶液中的亚铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)根据几种金属离子的氢氧化物开始沉淀和完全沉淀的pH,“调pH并过滤”时,调整pH的目的是沉淀铁离子和铝离子,但不能使锰离子沉淀,pH范围为5.0~7.8,滤渣1的主要成分为Fe(OH)3和Al(OH)3,故答案为:5.0~7.8;Fe(OH)3和Al(OH)3;
(4)碳酸钠与硫酸锰反应生成碳酸锰,加入磷酸使碳酸锰生成Mn(H2PO4)2,反应的化学方程式为MnCO3+2H3PO4=Mn(H2PO4)2+CO2↑+H2O,故答案为:MnCO3+2H3PO4=Mn(H2PO4)2+CO2↑+H2O;
(5)根据MnO2 ~ Mn(H2PO4)2·2H2O
87 285
1t×87%×(1-9%) m[Mn(H2PO4)2·2H2O]
则![]() =
=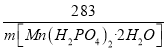
解得m[Mn(H2PO4)2·2H2O]≈2.59t,故答案为:2.59。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)Al2(SO4)3溶液显酸性的离子方程式:____________________________;
(2)CuSO4溶液与过量氨水反应的离子方程式:____________________________;
(3)Mg-Al-NaOH溶液组成的原电池,负极的电极反应式:_________________________;
(4)CH3OH-O2燃料电池,KOH溶液作电解质,负极的电极反应式:____________________;
(5)惰性电极电解CuSO4溶液的总反应的化学方程式:______________________________;
(6)Na2C2O4溶液的物料守恒:______________________________;
(7)Fe3+的基态电子排布式:______________________________;
(8)N2H4的结构式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 CaCl2溶液中:Ag+、Cu2+、SCN-、![]()
B.能使甲基橙变红的溶液中:Na+、Mg2+、![]() 、Cl-
、Cl-
C.![]() =1×10-12 mol·L-1的溶液:K+、Na+、
=1×10-12 mol·L-1的溶液:K+、Na+、![]() 、
、![]()
D.0.1 mol·L-1 FeSO4溶液中:Na+、![]() 、ClO-、
、ClO-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将Cl2通入水中,Cl2部分与水反应:Cl2+H2![]() OH++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量___。
OH++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量___。
A.AgNO3晶体 B.CaCO3粉末 C.NaCl晶体 D.蒸馏水 E.浓盐酸
(2)在一定条件下,同时加入CO、H2O(g)、CO2、H2于一密闭容器中发生如下反应:CO+H2O(g)![]() CO2+H2,反应开始时向右进行。下列说法中不正确的是___。
CO2+H2,反应开始时向右进行。下列说法中不正确的是___。
A.反应开始时,正反应速率大于逆反应速率
B.反应开始时,正反应速率最大,逆反应速率为零
C.随着反应的进行,正反应速率逐渐减小,最后为零
D.随着反应的进行,逆反应速率增大,正反应速率减小,最后相等
(3)一定条件下(温度恒定),SO2与O2反应的浓度随时间的变化如下表。
时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
c(SO2)/(mol·L-1) | 1.0 | |||||||
c(O2)/(mol·L-1) | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
c(SO3)/(mol·L-1) | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
由上表数据计算:
A.30~40min时间段,以SO2表示的反应速率为___;
B.该温度下,正反应的平衡常数的值为___;
C.平衡时,SO2的转化率为___。
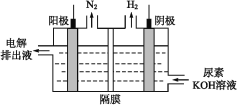
(4)电解尿素的碱性溶液制氢气的装置示意图见如图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为___。
(5)3.04g铜镁合金完全溶解于100mL密度为1.40g·cm-3、质量分数为63%的硝酸中,得到NO2气体2688mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。则加入NaOH溶液的体积是___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W,A是短周期中原子半径最大的元素,常温下X、Z、W均可与Y反应,A、C、D的原子序数及0.1mol/L X、Z、W溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
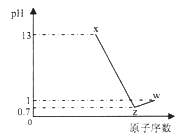
A. A的离子半径小于B的离子半径
B. W、X两物质含有的化学键类型相同
C. D氢化物稳定性小于C氢化物稳定性
D. B的简单离子会影响水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) △H=-159.5kJ·mol-1
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) △H=+116.5kJ·mol-1
③H2O(1)===H2O(g) △H=+44kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为___________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:

①根据如图判断该反应的△H___________0(填“>”“<”或“=”),理由是___________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO)2=___________,反应的平衡常数K=______(保留三位小数)
③该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有______(填编号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH___________(填“增大”“减小”或“不变”),负极的电极反应式为___________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为___________;常温下将 a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈___________(填“酸”“碱”或“中”)性,溶液中c(HN3)=___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率= ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
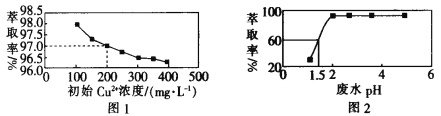
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com