
【题目】(1)将Cl2通入水中,Cl2部分与水反应:Cl2+H2![]() OH++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量___。
OH++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量___。
A.AgNO3晶体 B.CaCO3粉末 C.NaCl晶体 D.蒸馏水 E.浓盐酸
(2)在一定条件下,同时加入CO、H2O(g)、CO2、H2于一密闭容器中发生如下反应:CO+H2O(g)![]() CO2+H2,反应开始时向右进行。下列说法中不正确的是___。
CO2+H2,反应开始时向右进行。下列说法中不正确的是___。
A.反应开始时,正反应速率大于逆反应速率
B.反应开始时,正反应速率最大,逆反应速率为零
C.随着反应的进行,正反应速率逐渐减小,最后为零
D.随着反应的进行,逆反应速率增大,正反应速率减小,最后相等
(3)一定条件下(温度恒定),SO2与O2反应的浓度随时间的变化如下表。
时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
c(SO2)/(mol·L-1) | 1.0 | |||||||
c(O2)/(mol·L-1) | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
c(SO3)/(mol·L-1) | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
由上表数据计算:
A.30~40min时间段,以SO2表示的反应速率为___;
B.该温度下,正反应的平衡常数的值为___;
C.平衡时,SO2的转化率为___。
(4)电解尿素的碱性溶液制氢气的装置示意图见如图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为___。
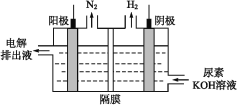
(5)3.04g铜镁合金完全溶解于100mL密度为1.40g·cm-3、质量分数为63%的硝酸中,得到NO2气体2688mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。则加入NaOH溶液的体积是___mL。
【答案】CE BC 0.015mol·L-1·min-1 1620 90%(或0.9) CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O 1280
【解析】
(1)根据影响平衡移动的因素进行分析作答;
(2)根据影响化学平衡状态的建立因素进行分析作答;
(3) 根据化学反应速率和化学平衡的公式进行直接计算;
(4)考查电极反应式的书写,环境是碱性,根据电解示意图,阳极得到N2,因此是CO(NH2)2在阳极上放电;
(5)考查化学计算,当金属离子全部转化成沉淀时,溶液中的溶质为NaNO3,根据元素守恒有,可得答案。
(1) A. 加入硝酸银晶体,AgNO3与Cl-反应生成氯化银沉淀,平衡右移,A项错误;
B. 加入碳酸钙固体,与氢离子反应,平衡右移,B项错误;
C. 加入NaCl晶体,增加氯离子浓度,平衡左移,抑制氯气的溶解,C项正确;
D. 加水稀释,促进氯气的溶解,D项错误;
E. 加入浓盐酸,氯离子浓度增大,平衡向逆反应方向移动,抑制氯气的溶解,E项正确;
故答案为:CE;
(2) A. 反应开始时,因为反应向右进行,因此正反应速率大于逆反应速率,A项正确;
B. 因为同时加入CO、H2O(g)、CO2、H2,且此反应是可逆反应,因此正逆反应同时进行,开始时向右进行,正反应速率最大,逆反应速率最小,但不等于0,只不过正反应方向速率大于逆反应方向速率,B项错误;
C. 随着反应的进行,正反应速率逐渐减小,当正、逆反应速率相等,化学平衡建立,但正反应速率不等于0,C项错误;
D. 随着反应进行,正反应速率减小,逆反应速率增大,当两者相等时,化学平衡建立,D项正确;
故答案为:BC;
(3) A.v(SO3)=![]() mol·L-1·min-1=0.015mol·L-1·min-1,根据化学反应速率之比等于化学计量数之比,因此v(SO2)=v(SO3)=0.015mol·L-1·min-1,故答案为:0.015mol·L-1·min-1;
mol·L-1·min-1=0.015mol·L-1·min-1,根据化学反应速率之比等于化学计量数之比,因此v(SO2)=v(SO3)=0.015mol·L-1·min-1,故答案为:0.015mol·L-1·min-1;
B. 达到化学平衡时c(SO2)=![]() mol·L-1=0.1mol·L-1,根据化学平衡常数的表达式,K=
mol·L-1=0.1mol·L-1,根据化学平衡常数的表达式,K=![]() =1620,故答案为1620;
=1620,故答案为1620;
C. SO2的转化率为α(SO2)=![]() ×100%=90%,故答案为:90%(或0.9);
×100%=90%,故答案为:90%(或0.9);
(4)根据电解示意图,阳极得到N2,因此是CO(NH2)2在阳极上放电,因此电极反应式为CO(NH2)2+8OH--6e-=C![]() +N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
+N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(5)当金属离子全部转化成沉淀时,溶液中的溶质为NaNO3,根据元素守恒有,n(NaOH)=n(NaNO3)=n(HNO3)-n(NO2)=![]() =1.28mol,因此需要的氢氧化钠溶液的体积为
=1.28mol,因此需要的氢氧化钠溶液的体积为![]() ×103mL·L-1=1280mL,故答案为:1280。
×103mL·L-1=1280mL,故答案为:1280。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 用FeS去除废水中的Hg2+:Hg2+ + S2- === HgS↓
C. AlCl3溶液与Na2S溶液混合生成沉淀::2 Al3++3S2-==Al2S3↓
D. NH4Cl溶于D2O中显酸性:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“锂—呼吸CO2电化学装置”放电时的原理如下图所示,下列说法正确的是
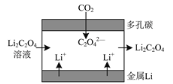
A.金属Li电极发生还原反应
B.多孔碳电极的电极反应式为:2CO2+2e-=C2O42-
C.每生成0.1 mol Li2C2O4,电路中有0.1 mol e-发生转移
D.电池“吸入”CO2时将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加___溶液,溶液颜色无明显变化,由此可知样品中无Fe3+。
(2)为测定绿矾中结晶水含量,称石英玻璃管(带开关K1和K2)(设为装置A)的质量,记为m1g。将样品装入石英玻璃管中,再次称其质量,记为m2g。按如图连接好装置进行实验。

①仪器B的名称是___。
②将下列实验操作步骤正确排序___(填字母);重复上述操作步骤,直至A质量不变,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式,结晶水数目x=___。若实验时按a、d次序操作,则使x___(填偏大偏小或无影响)。
(3)为探究硫酸亚铁的分解产物,将(2)中已质量不变的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
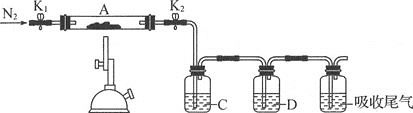
①C、D中的溶液依次为___(填字母),可观察到C、D中有气泡冒出。
a.品红 b.NaOH C.BaCl2 d.Ba(NO3 )2 e.浓硫酸
②写出硫酸亚铁高温分解反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn(H2PO4)2·2H2O是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备Mn(H2PO4)2·2H2O的流程如图:
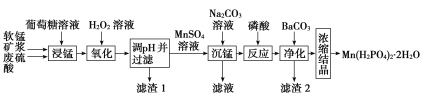
(1)软锰矿要先制成矿浆的目的是__,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为:__。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表,“调pH并过滤”时,应调整的pH范围为__,滤渣1的主要成分为__(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为__。
(5)某工厂用上述流程制备Mn(H2PO4)2·2H2O,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1吨该软锰矿可制得Mn(H2PO4)2·2H2O__t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构为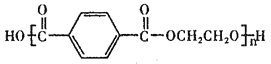 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:
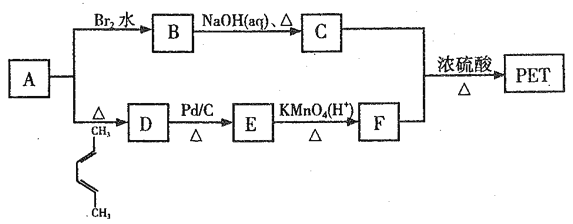
已知:①![]() ;②
;②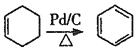 。
。
根据题意回答下列问题:
(1)A的名称是_______,C所含官能团的名称是_______。
(2)由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚l,3-丁二烯的结构简式_______。
(3)A→D、B→C的反应类型分别为_______ 、_______。
(4)写出C+F→PET的化学反应方程式______________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有_____种。
(6)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶(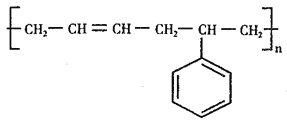 )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司 Tiamat 日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从 2020 年开始实现工业生产。该电池的负极材料为 Na2Co2TeO6(制备原料为 Na2CO3、Co3O4和TeO2),电解液为 NaClO4 的碳酸丙烯酯溶液。 回答下列问题:
(1)Te 属于元素周期表中______区元素,其基态原子的价电子排布式为______。
(2)基态 Na 原子中,核外电子占据的原子轨道总数为______,最高能层电子云轮廓图形状为______。
(3)结合题中信息判断:C、O、Cl 的电负性由大到小的顺序为______ (用元素符号表示)。
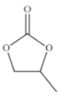
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为______,1mol 碳酸丙烯酯中σ键的数目为______。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是______,该配离子包含的作用力为______ (填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
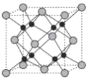
(6)Na 和 O 形成的离子化合物的晶胞结构如图所示,晶胞中 O 的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为 NA,则Na与O之间的最短距离为______cm(用 ρ、NA 的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com