
【题目】“锂—呼吸CO2电化学装置”放电时的原理如下图所示,下列说法正确的是
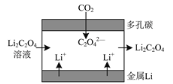
A.金属Li电极发生还原反应
B.多孔碳电极的电极反应式为:2CO2+2e-=C2O42-
C.每生成0.1 mol Li2C2O4,电路中有0.1 mol e-发生转移
D.电池“吸入”CO2时将电能转化为化学能
【答案】B
【解析】
观察“锂—呼吸CO2电化学装置”可知,负极:Li→Li+,失电子,发生氧化反应;正极:CO2→C2O42-,得电子,发生还原反应;总反应:2CO2+2Li===C2O42-+2Li+。
A. 根据分析可知,金属Li电极发生氧化反应, A选项错误;
B. 根据分析可知,多孔碳电极变化为CO2→C2O42-,所以电极反应式为:2CO2+2e-=C2O42-,B选项正确;
C. CO2→C2O42-,C化合价降低1,转移电子数等于总失电子数,所以,每生成0.1 mol Li2C2O4,电路中发生转移的电子为:0.1 mol ×1×2=0.2 mol,C选项错误;
D. 该电池为原电池,将化学能转化为电能,D选项错误;
答案选B。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】维生素C是广泛存在于新鲜水果蔬菜及许多生物中的一种重要的维生素,作为一种高活性物质,它参与许多新陈代谢过程。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
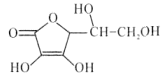 +I2
+I2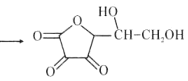 +2HI
+2HI
下列说法正确的是( )
A.上述反应说明维生素C能使碘水褪色,该反应的反应类型为取代反应
B.维生素C可发生取代反应、加成反应、氧化反应
C.维生素C可以水解得到2种产物
D.维生素C不可溶于水,可以溶于有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L1的盐酸滴定20 mL约0.1 mol·L1氨水,滴定曲线如图所示,下列说法正确的是
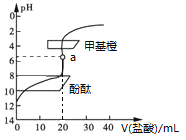
A. a点溶液中:c(H+)=c(OH)+c(NH3·H2O)
B. 滴定过程中,当溶液的pH=7时,两者恰好中和
C. 用酚酞作指示剂比用甲基橙作指示剂,滴定误差更小
D. 当滴入盐酸为30 mL时,溶液中:c(NH4+)+c(H+)<c(OH)+c(Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氧化铝基废催化剂(主要成分为![]() ,还含有少量Pd)回收
,还含有少量Pd)回收![]() 及Pd的流程如图:
及Pd的流程如图:
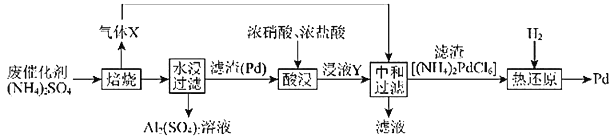
(1)![]() 溶液蒸干灼烧后所得物质的化学名称是_________。
溶液蒸干灼烧后所得物质的化学名称是_________。
(2)焙烧时![]() 与
与![]() 反应的化学方程式为__________。
反应的化学方程式为__________。
(3)浸液Y中含Pd元素的溶质是______(填化学式)。
(4)“热还原”中每生成![]() 生成的气体的物质的量为_________(已知热还原得到的固体只有Pd)。
生成的气体的物质的量为_________(已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为![]() ,其中x的最大值为0.8。已知:Pd的密度为
,其中x的最大值为0.8。已知:Pd的密度为![]() ,则
,则![]() 能储存标准状况下
能储存标准状况下![]() 的最大体积为________L(保留三位有效数字)。
的最大体积为________L(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 CaCl2溶液中:Ag+、Cu2+、SCN-、![]()
B.能使甲基橙变红的溶液中:Na+、Mg2+、![]() 、Cl-
、Cl-
C.![]() =1×10-12 mol·L-1的溶液:K+、Na+、
=1×10-12 mol·L-1的溶液:K+、Na+、![]() 、
、![]()
D.0.1 mol·L-1 FeSO4溶液中:Na+、![]() 、ClO-、
、ClO-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图。其中A是一种酸式盐,E的相对分子质量比D的相对分子质量大16,当x为一种强酸时,有如下转化关系。下列说法不正确的是( )
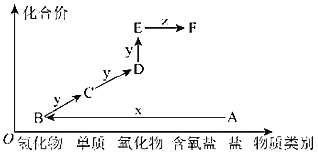
A.物质A、B、C、D、E、F中均含有硫元素
B.物质D可以使石蕊溶液先变红后褪色
C.物质C可在纯氧中燃烧,火焰呈蓝紫色
D.物质F的浓溶液可以用铁制容器盛放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将Cl2通入水中,Cl2部分与水反应:Cl2+H2![]() OH++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量___。
OH++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量___。
A.AgNO3晶体 B.CaCO3粉末 C.NaCl晶体 D.蒸馏水 E.浓盐酸
(2)在一定条件下,同时加入CO、H2O(g)、CO2、H2于一密闭容器中发生如下反应:CO+H2O(g)![]() CO2+H2,反应开始时向右进行。下列说法中不正确的是___。
CO2+H2,反应开始时向右进行。下列说法中不正确的是___。
A.反应开始时,正反应速率大于逆反应速率
B.反应开始时,正反应速率最大,逆反应速率为零
C.随着反应的进行,正反应速率逐渐减小,最后为零
D.随着反应的进行,逆反应速率增大,正反应速率减小,最后相等
(3)一定条件下(温度恒定),SO2与O2反应的浓度随时间的变化如下表。
时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
c(SO2)/(mol·L-1) | 1.0 | |||||||
c(O2)/(mol·L-1) | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
c(SO3)/(mol·L-1) | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
由上表数据计算:
A.30~40min时间段,以SO2表示的反应速率为___;
B.该温度下,正反应的平衡常数的值为___;
C.平衡时,SO2的转化率为___。
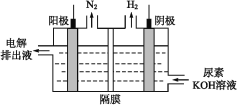
(4)电解尿素的碱性溶液制氢气的装置示意图见如图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为___。
(5)3.04g铜镁合金完全溶解于100mL密度为1.40g·cm-3、质量分数为63%的硝酸中,得到NO2气体2688mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。则加入NaOH溶液的体积是___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.可直接根据Ksp的数值大小比较难溶物在水中的溶解度
B.AgCl易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl)
C.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com