
【题目】某烷烃的相对分子质量为86,其一氯代物只有两种,则它的结构简式、名称都正确的是( )
A.![]() 己烷
己烷
B.![]() 2,3-二甲基丁烷
2,3-二甲基丁烷
C.![]() 3-甲基戊烷
3-甲基戊烷
D.![]() 2,2-二甲基丁烷
2,2-二甲基丁烷
科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________________,K值大小与温度的关系是:温度升高,K值__________(填一定增大、一定减小、或可能增大也可能减小)。
(2)已知反应Cl2+H2O![]() HCl+HClO,写出该反应化学平衡常数的表达式_____________
HCl+HClO,写出该反应化学平衡常数的表达式_____________
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-QkJ/mol (Q>0)
CO2(g)+H2(g) ΔH=-QkJ/mol (Q>0)
CO和H2O浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
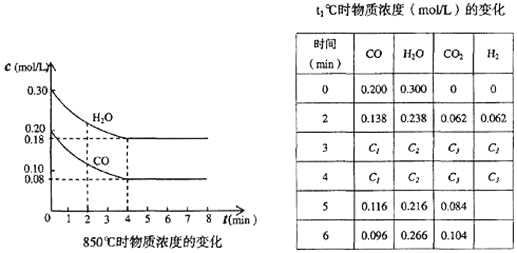
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是_______,表中5 min~6 min之间数值发生变化,可能的原因是_______。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶盐CaCO3在下列溶液中溶解度最大的是( )
A.0.1 mol·L-1CH3COOHB.0.10 mol·L-1CaSO4C.纯水D.1.0 mol·L-1Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
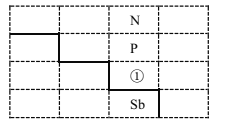
(1)写出元素①的元素符号________,与①同周期的主族元素中,第一电离能比①大的有_______种。
(2)基态锑(Sb)原子的价电子排布式为_______。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+离子的空间构型为______,写出一种与[H2F]+互为等电子体的分子 ____ 。
(3)下列说法正确的是________
a.N2H4分子中含5个σ键和1个π键
b.基态P原子中,电子占据的最高能级符号为M
c.Sb 位于p区
d.升温实现―液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性 共价键。
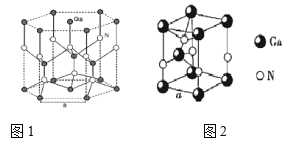
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,解释GaN、GaP熔点变化原因________。

(5)GaN晶胞结构如图1所示,已知六棱柱底边边长为a cm。
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为________;
②从GaN 晶体中分割出的平行六面体如图 。若该平行六面体的体积为![]() a3cm3,GaN 晶体的密度为______g/cm3 (用a、NA 表示)。
a3cm3,GaN 晶体的密度为______g/cm3 (用a、NA 表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入___________调至溶液pH=4,使Fe3+转化为Fe(OH) 3沉淀,此时溶液中的c(Fe3+)=_____________。
(2)过滤后,将所得滤液经过________,________操作,可得到CuCl2·2H2O晶体。
(3)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是________________。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。过滤后,滤液用0.1000 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL。(已知:I2+2S2O32-=S4O32-+2I-)。
①可选用________作滴定指示剂,滴定终点的现象是__________________________。
②CuCl2溶液与KI反应的离子方程式为________________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)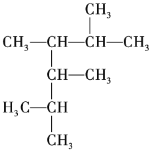 的名称为______。
的名称为______。
(2)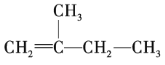 的名称为______。
的名称为______。
(3)3-甲基-2-戊烯的结构简式为______。
(4)1,3,5-三甲基苯的结构简式为______。
(5)某烷烃的相对分子质量为72,其一氯代物只有一种,该烷烃的结构简式为______。
(6)2,3-二甲基-2-丁烯的键线式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,通过它可以得到很多重要的化工产品。

已知: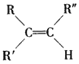
![]()
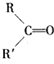 +
+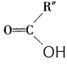
(1)B和A为同系物,B的结构简式为_______,写出B与氯气加成后的产物名称______。
(2)反应②的化学方程式为__________,其反应类型为_________。
(3)写出检验C3H5Cl中含有Cl原子的方法_____________。
(4)C的结构简式为_______________,其官能团的名称为__________。
(5)反应④的化学方程式为______________。
(6)石油裂解气中还含有丙炔,为研究物质的芳香性,可将CH![]() C-CH3三聚得到苯的同系物,其可能的结构简式有_______种。
C-CH3三聚得到苯的同系物,其可能的结构简式有_______种。
(7)设计一条由乙烯为原料制备D的合成路线________ (其他无机原料任选)。合成路线常用的表示方式为:A![]() B
B![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F的原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为1s22s22p6,A原子核外有2个未成对电子,且无空轨道,C单质可与热水反应但很难与冷水反应;E、F原子在基态时填充电子的轨道数为9,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子。
(1)上述六种元素中,第一电离能最大的是__(填元素符号),理由是__。
(2)比较C、D元素的第一电离能:__>__(填元素符号),理由是__。
(3)题述六种元素的电负性由小到大的顺序为__。
(4)C、D、E、F元素形成的最高价氧化物是离子化合物的有__(填化学式,下同),是共价化合物的有__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com